题目内容
4.已知下表数据:| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中[SO42-]:([Cu2+]+[Fe2+]+[Fe3+])>5:4.([SO42-]表示SO42-物质的量浓度 ) | |
| C. | 向该溶液中加入适量氯水,并调节pH到3.4过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=4的溶液中Fe3+不能大量存在 |
分析 A.由表中数据可知完全沉淀时Fe(OH)3pH最小,则最先生成沉淀;
B.设物质的量都为1mol,结合物质的组成以及水解的性质判断;
C.加入氯水,可生成氯化物;
D.由表中数据可知pH≥3.4时铁离子完全沉淀.
解答 解:A.由表中数据可知完全沉淀时Fe(OH)3pH最小,最先生成沉淀,则向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀,故A正确;
B.设物质的量都为1mol,可知SO42-为5mol,金属离子共为4mol,但金属离子水解,则[SO42-]:([Cu2+]+[Fe2+]+[Fe3+])>5:4,故B正确;
C.加入氯水,可生成氯化物,引入新杂质,故C错误;
D.由表中数据可知pH≥3.4时铁离子完全沉淀,则在pH=4的溶液中Fe3+不能大量存在,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意把握溶度积的大小与物质的性质,易错点为B,注意离子水解的性质,难度不大.

练习册系列答案
相关题目
15.下列同一组反应的反应类型不相同的是( )
| A. | 1-丁烯使溴水褪色,乙炔制取氯乙烯 | |
| B. | 苯乙烯制取聚苯乙烯,四氟乙烯制取聚四氟乙烯 | |
| C. | 1-己烯使KMnO4酸性溶液褪色,甲苯使KMnO4酸性溶液褪色 | |
| D. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 |
16.下列化学反应,能用离子方程式Ba2++SO42-═BaSO4↓表示的是( )
| A. | 硫酸溶液与氢氧化钡溶液 | B. | 氯化钡溶液与硫酸钾溶液 | ||
| C. | 碳酸钡与稀硫酸 | D. | 氢氧化钡溶液与硫酸铜溶液 |
13.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 19.6mol/L的硫酸溶液.
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 19.6mol/L的硫酸溶液.
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
20.用98%,密度为1.84g/cm3的浓硫酸配制1mol/L的稀硫酸100mL,配制过程中需要用到的仪器及使用的先后顺序排列正确的是( )
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL 容量瓶⑥胶头滴管 ⑦玻璃棒.
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL 容量瓶⑥胶头滴管 ⑦玻璃棒.
| A. | ②⑥⑤⑦⑥ | B. | ④⑥③⑦⑤⑥ | C. | ②⑥③⑦⑤⑥ | D. | ①⑥③⑤⑥⑦ |
9. A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第ⅤA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
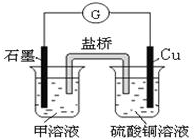
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
14.在体积可变的密闭容器中,反应 mA(g)+nB(s)?pC(g)达到平衡后,压缩容器的体积,发现 A 的转 化率随之降低.下列说法中正确的是( )
| A. | (m+n)必定小于 p | B. | (m+n)必定大于 p | C. | m 必定小于 p | D. | n 必定大于 p |