题目内容
13.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 19.6mol/L的硫酸溶液.
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
分析 可以通过增大盐酸浓度、升高温度等方法来改变,但改变条件时不能加入和稀盐酸反应生成氢气的物质,据此分析解答.
解答 解:①滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,且生成氢气量不变,故正确;
②加NaCl溶液,氢离子浓度降低,反应速率减慢,故错误;
③滴入几滴硫酸铜溶液,Fe和铜离子发生置换反应生成Cu,Fe、Cu和稀盐酸构成原电池而加快反应速率,但生成氢气总量减小,故错误;
④升高温度(不考虑盐酸挥发),增大活化分子百分数,化学反应速率增大,且不影响生成氢气总量,故正确;⑤改用 19.6mol/L的硫酸溶液,浓硫酸和Fe发生钝化现象,导致生成氢气总量减小,故错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,浓度、温度、催化剂、反应物接触面积、压强都是影响化学反应速率因素,注意这些外界条件的适用范围,注意:浓硫酸和Fe、Al易发生钝化现象,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
3.下列物质既能使溴的四氯化碳溶液褪色,又能使酸性高锰酸钾溶液褪色的是( )
| A. | CH3CH=CH2 | B. |  | C. |  | D. |  |
4.下列关于芳香烃的叙述中正确的是( )
| A. | 乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 | |
| B. | 苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在1000时即可生成三硝基甲苯,说明苯环对甲基产生了影响 | |
| C. | 福尔马林(甲醇的水溶液)是混合物,可用来制作生物标本 | |
| D. | 除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,然后分液即可 |
18.某有机物M的结构简式为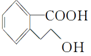 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )
 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
4.已知下表数据:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中[SO42-]:([Cu2+]+[Fe2+]+[Fe3+])>5:4.([SO42-]表示SO42-物质的量浓度 ) | |
| C. | 向该溶液中加入适量氯水,并调节pH到3.4过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=4的溶液中Fe3+不能大量存在 |
2.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应为吸热反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a< b (填“>”、“<”或“=”).
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a< b (填“>”、“<”或“=”).
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.