题目内容
16.钨是我国丰产元素.科研专家经过长期勘测评审,于2016年元月确认江西省浮梁县存在着世界上最大的钨矿.从而进一步确立了江西省“世界钨都”的地位.自然界中钨有部分是以钨(+6价)酸盐的形式存在.黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4).含有SiO2、Al2O3等杂质.现用黑钨矿制备金属钨的流程图如下: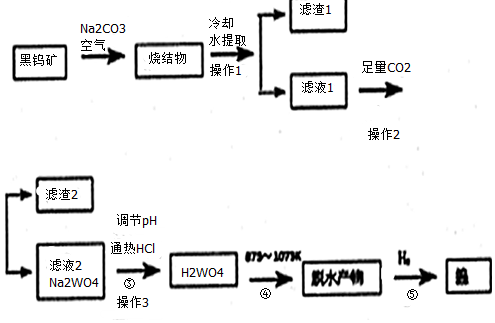
说明:a:反应①是在高温熔融下进行的,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4
b:生成Fe2O3的反应为:4FeWO4+4Na2CO3+O2═4Na2WO4+4CO2+2Fe2O3
c:在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸与杂质分离,灼烧后即为三氧化钨
回答下列问题:
(1)写出烧结物中生成Na2SiO3的化学反应方程式:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,生成Mn2O4与生成Fe2O3所发生的反应原理相同,请写出生成Mn3O4的化学反应方程式:6MnWO4+6NaCO3+O2=6Na2WO4+6CO2+2Mn3O4.
(2)操作3需要用到玻璃仪器的有:玻璃棒、烧杯、漏斗.
(3)通入足量CO2时发生的离子反应方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-、CO2+SiO32-+H2O=H2SiO3↓+2HCO3-.
(4)上述流程最后步骤中钨的制备属于工业冶炼金属的何种方法热还原法.
(5)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种黄色的、非整比的钨的氧化物WO(3-x),这种蓝色氧化钨具有比表面大、易还原得优点.一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种状态的钨,若x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为1:4.
分析 黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4).含有SiO2、Al2O3等杂质在空气中加入氢氧化钠熔融,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4,冷却溶解过滤得到滤液A,在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸B与杂质分离,灼烧后即为三氧化钨,氢气还原氧化钨得到金属钨,
(1)烧结物中生成Na2SiO3的化学反应是二氧化硅和碱反应生成,如碳酸钠和二氧化硅混合加热反应生成硅酸钠和二氧化碳,生成Mn3O4的化学反应是依据反应4FeWO4+4Na2CO3+O2═4Na2WO4+4CO2+2Fe2O3类推得到;
(2)操作3为过滤,据此选择需要的仪器;
(3)滤液1中通入过量二氧化碳是溶液中偏铝酸根离子和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,二氧化碳和硅酸根离子反应生成白色沉淀硅酸;
(4)脱水产物为WO3,通入氢气还原生成钨金属,属于热还原法;
(5)钨的氧化物WO(3-x)中x=0.1,则钨的氧化物为WO2.9,根据十字交叉法来计算回答.
解答 解:(1)烧结物中生成Na2SiO3的化学反应是二氧化硅和碱反应生成,如碳酸钠和二氧化硅混合加热反应生成硅酸钠和二氧化碳,烧结物中生成Na2SiO3的化学反应方程式为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,生成Mn3O4的化学反应是结合反应4FeWO4+4Na2CO3+O2═4Na2WO4+4CO2+2Fe2O3,类推得到,生成Mn2O4与生成Fe2O3所发生的反应原理相同,生成Mn3O4的化学反应方程式为:6MnWO4+6NaCO3+O2=6Na2WO4+6CO2+2Mn3O4,
故答案为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;6MnWO4+6NaCO3+O2=6Na2WO4+6CO2+2Mn3O4;
(2)操作3为分离溶液和固体的过滤操作,需要用到玻璃仪器的有:玻璃棒、烧杯、漏斗,
故答案为:玻璃棒、烧杯、漏斗;
(3)滤液1中通入过量二氧化碳是溶液中偏铝酸根离子和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,通入足量CO2时发生的离子反应方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,二氧化碳和硅酸根离子反应生成白色沉淀硅酸,反应的离子方程式为:CO2+SiO32-+H2O=H2SiO3↓+2HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;CO2+SiO32-+H2O=H2SiO3↓+2HCO3-;
(4)分析可知,H2WO4脱水产物为WO3,通入氢气还原生成钨金属,WO3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$W+3H2O冶炼的方法,属于热还原法,故答案为:热还原法;
(5)钨的氧化物WO(3-x)中x=0.1,则钨的氧化物为WO2.9,可用十字交叉法求算: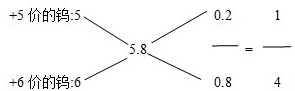 ,
,
故答案为:1:4
点评 本题意工艺流程题为载体,综合考查学生氧化还原以及金属的冶炼等方面的知识,题目难度中等.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | CH2F2的电子式: | |
| B. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I | |
| C. | 16O的原子结构示意图: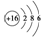 | |
| D. | 间羟基苯甲醛的结构简式: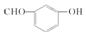 |
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中[SO42-]:([Cu2+]+[Fe2+]+[Fe3+])>5:4.([SO42-]表示SO42-物质的量浓度 ) | |
| C. | 向该溶液中加入适量氯水,并调节pH到3.4过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=4的溶液中Fe3+不能大量存在 |
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(Z) | n(Y) | ||
| ① | 600 | 1 | 0 | 0 | 0.8 |
| ② | 600 | 0.1 | a | 0.9 | 0.8 |
| ③ | 600 | 0 | 1.5 | 1.5 | b |
| ④ | 500 | 0.5 | 1.2 | 1.0 | c |
| A. | 实验②起始时V(逆)<v(正)且a=0.9 | |
| B. | 600℃时,该反应平衡常数K=3.2 moI/L | |
| C. | 实验③中b<1.2 | |
| D. | 若b>c,则△H<O |
(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变填(“增大”、“减小”或“不变”).
(2)下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
(3)在T2温度下,反应1000s时测得N2O5的浓度为3.00mol/L,则T2<T1(填“>“、“<”或“=”).
(二)工业上用重晶石(主要成分为BaSO4)制备BaCl2
(1)BaSO4与碳在高温下反应生成一氧化碳与金属硫化物,该反应中每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.(Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10)
(3)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
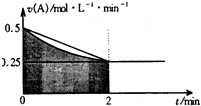 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
| A. | 油脂是人体不可缺少的营养物质 | |
| B. | 油脂的水解产物是氨基酸 | |
| C. | 油脂主要在小肠中被消化吸收 | |
| D. | 脂肪中多不饱和酸含量越高,其营养价值也越高 |
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.