题目内容
9. A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
分析 A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为N元素;C单质在实验室一般保存在煤油中,C为Na元素;由元素在周期表的位置可知,E为C,B为O,D为Cl,F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,F为Al;G单质是日常生活中用量最大的金属,易被腐蚀,G为Fe,
(1)A为N,位于第二周期第VA族;
(2)A与B可组成质量比为7:16的三原子分子,分子为SO2;
(3)A和C组成的一种离子化合物为Na3N,能与水反应生成两种碱为NaOH和一水合氨;
(4)A氢化物的气体和D的氢化物气体反应生成固体氯化铵;
(5)F的单质与NaOH溶液反应生成偏铝酸钠和氢气;
(6)D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,可知Cu失去电子,铁离子得到电子.
解答 解:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为N元素;C单质在实验室一般保存在煤油中,C为Na元素;由元素在周期表的位置可知,E为C,B为O,D为Cl,F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,F为Al;G单质是日常生活中用量最大的金属,易被腐蚀,G为Fe,
(1)A为N,位于第二周期第VA族,故答案为:第二周期第ⅤA族;
(2)A与B可组成质量比为7:16的三原子分子,分子为SO2,该分子释放在空气中可能引起的环境问题有酸雨(或光化学烟雾),
故答案为:酸雨(或光化学烟雾);
(3)A和C组成的一种离子化合物为Na3N,能与水反应生成两种碱为NaOH和一水合氨,反应为Na3N+4H2O=NH3.H2O+3NaOH,
故答案为:Na3N+4H2O=NH3.H2O+3NaOH;
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl,
故答案为:产生白烟;NH3+HCl=NH4Cl;
(5)F的单质与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,可知Cu失去电子,铁离子得到电子,则设计原电池的正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+,故答案为:2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意物质的性质及原电池的设计,题目难度不大.

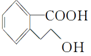 ,下列有关M的说法正确的是( )
,下列有关M的说法正确的是( )| A. | 该分子中存在一个手性碳原子 | |
| B. | M的分子式为C9H10O3 | |
| C. | 1 mol M能与足量Na反应生成0.5 mol H2 | |
| D. | 1 mol M完全燃烧消耗10 mol O2 |
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中[SO42-]:([Cu2+]+[Fe2+]+[Fe3+])>5:4.([SO42-]表示SO42-物质的量浓度 ) | |
| C. | 向该溶液中加入适量氯水,并调节pH到3.4过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=4的溶液中Fe3+不能大量存在 |
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5KJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
CO(s)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0KJ•mol-1
则煤气化主要反应C(s)+H2O (g)═CO(g)+H2(g)的△H=+131.3 kJ/mol
(2)已知CO(g)+O2(g)═CO2(g)+O(g)的正反应速率为v正=k正•c(CO)•c(O2),逆反应速率为v逆=k逆•c(CO2)•c(O),k为速率常数.2500K时,k正=1.21×105 L/mol,k逆=3.02×105L/mol,则该温度下的反应平衡常数K=0.40
(3)甲醇制甲醚的有关反应为:2CH3OH (g)═CH3OCH 3(g)+H2O (g).一定温度下,在三个容积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.该温度下,若起始时向容器Ⅰ中冲入0.10molCH3OH (g)、0.15mol CH3OCH3(g)和0.10mol H2O(g),则反应将向正(填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为B.(填序号)
A.升高温度
B.降低温度
C.其他条件不变,增加CH3OH 的物质的量
D.保持其他条件不变,通入氖气
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示.

则电源的负极为B(填“A”或“B”),写出阳极的电极反应式:2CH3OH+CO-2e-=(CH3O)2CO+2H+
(5)将化石燃料的燃烧产物CO2通入NaOH溶液中可制得碳酸氢钠.取0.2mol/L碳酸钠溶液与0.2mol/L氯化钡溶液等体积混合产生浑浊,请结合一下数据,通过计算说明产生浑浊的原因:[已知:25℃时,0.1mol/L碳酸氢钠溶液中碳酸根离子的浓度为0.0011mol/L,Ksp(BaCO3)=5.1×10-9].
| A. | 蒸发操作时,应使混合物中的水分大部分蒸干后,停止加热,利用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 浓硫酸稀释时,应该将水缓缓加入盛浓硫酸的烧杯中,边加边搅拌 | |
| D. | 萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.