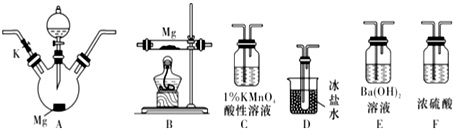
题目内容
8.下列离子方程式书写正确的是( )| A. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 用FeCl3溶液刻蚀铜电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 稀硝酸滴到大理石上:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
分析 A.二者反应生成氢氧化铝沉淀和氯化铵;
B.电荷不守恒;
C.碳酸钙为沉淀,应保留化学式;
D.二者反应生成硝酸铜和二氧化碳和水;
解答 解:A.AlCl3溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.用FeCl3溶液刻蚀铜电路板,离子方程式:Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.稀硝酸滴到大理石上,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故C错误;
D.铜和浓硝酸反应,离子方程式:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故D正确;
故选:AD.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分、注意电荷守恒,题目难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
18.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | ||
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是: H++NO2-=HNO2, 2HNO2=NO↑+NO2↑+H2O | |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 | |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 | |
| D | 苯酚钠溶液中通入足量二氧化碳产生浑浊 | 苯酚的酸性弱于碳酸 | |
| A. | A | B. | B | C. | C | D. | D |
19.金属冶炼的实质是( )
| A. | 金属元素失去电子 | |
| B. | 金属元素获得电子 | |
| C. | 金属元素被氧化了 | |
| D. | 金属元素可能被氧化了,也可能被还原了 |
16.最近科学家成功的制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
| A. | 该物质的化学式为CO2 | |
| B. | 晶体的熔沸点高、硬度大 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:4 | |
| D. | 该物质的性质与二氧化碳相似 |
3.下列措施能减慢化学反应速率的是( )
| A. | 将煤块粉碎后燃烧 | |
| B. | 用2mol/L的盐酸代替1mol/L的盐酸制取氢气 | |
| C. | 将食物贮藏在冰箱中 | |
| D. | 用H2O2溶液制取氧气时加入少量二氧化锰粉末 |
20.根据元素周期律的知识,下列两者性质比较中,正确的是( )
| A. | 热稳定性:HF<HCl | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H3PO4<H2SO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
17.现有反应m A(g)+n B(g)?w C(g),测得在同一时间内A每分钟减少0.15mol/L,B每分钟减少0.05mol/L,C每分钟增加0.1mol/L,则下列叙述不正确的是( )
| A. | 在体积和温度不变的条件下,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| B. | m:n:w=3:1:2 | |
| C. | 单位时间内反应物浓度的减少等于生成物浓度的增加 | |
| D. | 在体积和温度不变的条件下,若在前10 s内A减少了xmol,则在同条件下,前20 s减少小于2x mol |
18.为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验.下列说法正确的是( )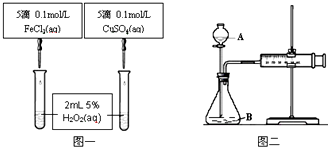

| A. | 图一可通过观察实验现象定量比较反应速率的大小 | |
| B. | 将CuSO4改为CuCl2更为合理 | |
| C. | 无法检查图二装置的气密性 | |
| D. | 图二所示实验中只需测量的数据是气体体积 |