题目内容
20.下列说法中正确的是( )| A. | 元素R 位于周期表的IB 族,其原子序数为a,则原子序数为a-3 的元素位于ⅥB 族 | |
| B. | 在元素周期表中 114 号元素的上一周期同一族元素的原子序数是 82 | |
| C. | 具有相同电子层结构的主族元素离子为X2+、Y+,则最高价氧化物的水化物的碱性X>Y | |
| D. | 在周期表中金属与非金属的分界线处可以找到催化剂和耐高温、耐腐蚀的合金材料 |
分析 A、元素R位于周期表的IB族,其原子序数为a,则原子序数为a-3的元素位于ⅤⅢ族;
B、在元素周期表中114号,位于第七周期,第ⅣA族,上一周期同一族元素的原子序数是114-32=82;
C、具有相同电子层结构的主族元素离子为X2+、Y+,所以Y的金属性强于X,金属性越强最高价氧化物对应水化物的碱性越强;
D、在过渡元素中找到催化剂和耐高温、耐腐蚀的合金材料.
解答 解:A、元素R位于周期表的IB族,其原子序数为a,则原子序数为a-3的元素位于ⅤⅢ族,而不是位于ⅥB族,故A错误;
B、在元素周期表中114号,位于第七周期,第ⅣA族,上一周期同一族元素的原子序数是114-32=82,故B正确;
C、具有相同电子层结构的主族元素离子为X2+、Y+,所以Y的金属性强于X,金属性越强最高价氧化物对应水化物的碱性越强,故C错误;
D、在过渡元素中找到催化剂和耐高温、耐腐蚀的合金材料,故D错误;
故选B.
点评 本题考查元素周期表、结构位置关系等,难度不大,注意整体把握周期表的结构.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
3.把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b molNaOH刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol BaCl2,由此可知原溶液中NO3-的物质的量浓度是(单位:mol•L-1)( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
10.下列式子中,属于水解反应的是( )
| A. | HCO3-+H2O?H3O-+CO32- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | NH3+H2O?NH3•H2O | D. | HCO3-+OH-═H2O+CO32- |
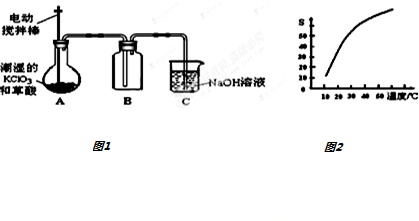
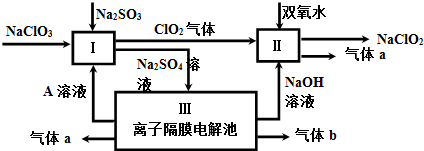


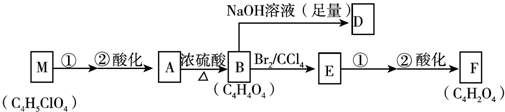
 +(2n-1)H2O.
+(2n-1)H2O. .
.