题目内容
15.设NA表示阿伏加德罗常数的值,下列有关叙述正确的有( )①标准状况下,20 g 重水(D2O)中含有的电子数为 10NA
②0.5 molFe2+被足量的 H2O2 溶液氧化,转移 0.5NA个电子
③将 2 mol NO 和 1 mol O2 混合后,体系中的分子总数为 3NA
④乙烯和环丙烷组成的 42 g 混合气体中氢原子的个数为 6NA
⑤2 mol•L-1 碳酸钠溶液中 Na+的数目是 2NA
⑥10LpH=1 的硫酸溶液中含有的 H+数为 2NA
⑦22.4 L 的 N2 的共用电子对数为 3NA
⑧将 0.1mol 氯化铁溶于 1L 水中,所得溶液含有 NA0.1个 Fe3+.
| A. | ①④⑥ | B. | ②③④ | C. | ①②④ | D. | ①②④⑧ |
分析 ①D2O中含有10个电子,摩尔质量是20g/mol;
②二价铁氧化生成三价铁,化合价升高1;
③2mol NO和1molO2混合后生成了1mol二氧化氮;
④乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数;
⑤溶液体积未知;
⑥依据pH=-lg[H+]计算氢离子浓度,依据n=CV计算氢离子的物质的量;
⑦气体状况未知,无法计算氮气的物质的量;
⑧Fe3+在溶液中发生水解,Fe3+的物质的量小于0.1mol.
解答 解:①20g重水(D2O)的物质的量是1mol,D2O分子中含有10个电子,含有的电子数为10NA,故①正确;
②0.5 molFe2+被足量的 H2O2 溶液氧化生成0.5mol三价铁离子,转移 0.5NA个电子,故②正确;
③2mol NO和1molO2混合后生成了1mol二氧化氮,体系中的分子总数小于3NA,故③错误;
④乙烯和环丙烷最简式相同为CH2,计算42gCH2中氢原子数=$\frac{42g}{14g/mol}$×2×NA=6NA,故④正确;
⑤溶液体积未知,无法计算钠离子个数,故⑤错误;
⑥10L pH=1的硫酸溶液中氢离子浓度为0.1mol/L,1L溶液中含有0.1mol氢离子,含有的H+离子数为NA,故⑥错误;
⑦气体状况未知,无法计算氮气的物质的量,无法计算N2 的共用电子对数,故⑦错误;
⑧Fe3+在溶液中发生水解,Fe3+的物质的量小于0.1mol,所以溶液含有Fe3+数目小于0.1NA个,故⑧错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,解题时注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,注意标况下的气体摩尔体积使用条件,题目难度中等.

练习册系列答案
相关题目
18.下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③双氧水 ④活性炭 ⑤二氧化硫 ⑥臭氧.
①过氧化钠 ②次氯酸 ③双氧水 ④活性炭 ⑤二氧化硫 ⑥臭氧.
| A. | ①②③⑤ | B. | 只有①②③⑥ | C. | ②③④⑤ | D. | 只有①③⑤⑥ |
10.25℃时,弱酸的电离平衡常数如下表,下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
20.下列说法中正确的是( )
| A. | 元素R 位于周期表的IB 族,其原子序数为a,则原子序数为a-3 的元素位于ⅥB 族 | |
| B. | 在元素周期表中 114 号元素的上一周期同一族元素的原子序数是 82 | |
| C. | 具有相同电子层结构的主族元素离子为X2+、Y+,则最高价氧化物的水化物的碱性X>Y | |
| D. | 在周期表中金属与非金属的分界线处可以找到催化剂和耐高温、耐腐蚀的合金材料 |
5.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:( )
*燃烧热:1mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量.根据表中数据,下列判断错误的是( )
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| *燃烧热(kJ•mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
| A. | 正庚烷在常温常压下肯定不是气体 | |
| B. | 直链烷烃燃烧热和其所含碳原子数呈线性关系 | |
| C. | 随碳原子数增加,直链烷烃沸点逐渐升高 | |
| D. | 随碳原子数增加,直链烷烃沸点和燃烧热都成比例增加 |
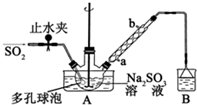 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: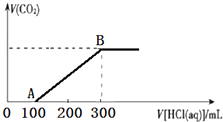 200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 .
. .
. .
.