题目内容
5.盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是为了提高Mg2+的浸取率.
(2)若室温下的溶液中Mg2+的浓度为6.0mol•L-1,则溶液pH≥8才可能产生Mg(OH)2沉淀.
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是高温下CaSO4•2H2O溶解度小,滤渣的主要成分是Al(OH)3、Fe(OH)3、CaSO4•2H2O.
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入NaOH溶液;②过滤,得沉淀;③向沉淀中加足量稀硫酸;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品.
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为20.0%(MgSO4•7H2O的相对分子质量为246).
分析 盐泥主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐),加入稀硫酸条件pH,硅酸盐生成硅酸沉淀,碳酸盐生成二氧化碳气体和阳离子,过滤除去难溶性物质,滤液Ⅰ中含Fe2+、Fe3+、Al3+、H+、Mg2+、Ca2+等阳离子,滤液Ⅰ到滤液Ⅱ需除去Fe2+、Fe3+、Al3+、H+、Ca2+.
(1)加入稀硫酸调pH为1~2以及煮沸是为了获得硫酸镁;
(2)根据氢氧化镁的Ksp=c(Mg2+)•c2(OH-)计算c(OH-),再计算溶液pH;
(3)加入NaClO将Fe2+氧化为Fe3+,调溶液pH约为5,Fe3+、Al3+转化为沉淀,高温下CaSO4•2H2O溶解度小,会析出晶体,过滤除去;
(4)滤液Ⅱ中含有NaCl、硫酸镁,将镁离子转化为氢氧化镁沉淀,过滤分离,再用硫酸溶解氢氧化镁,将溶液蒸发浓缩、降温结晶、过滤、洗涤得硫酸镁晶体;
(5)根据镁元素守恒结合关系式:MgSO4•7H2O~Mg(OH)2进行计算.
解答 解:盐泥主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐),加入稀硫酸条件pH,硅酸盐生成硅酸沉淀,碳酸盐生成二氧化碳气体和阳离子,过滤除去难溶性物质,滤液Ⅰ中含Fe2+、Fe3+、Al3+、H+、Mg2+、Ca2+等阳离子,滤液Ⅰ到滤液Ⅱ需除去Fe2+、Fe3+、Al3+、H+、Ca2+.
(1)在盐泥中加入稀硫酸调pH为1~2并煮沸的目的是为了:提高Mg2+的浸取率,
故答案为:为了提高Mg2+的浸取率;
(2)Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-)=6.0×10-12,溶液中Mg2+的浓度为6.0mol•L-1,则溶液中c(OH-)=$\sqrt{\frac{6.0×1{0}^{-12}}{6}}$mol/L=10-6mol/L,所以氢离子浓度为$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8mol/L,则pH=-lg10-8=8,
故答案为:8;
(3)加入NaClO将Fe2+氧化为Fe3+,调溶液pH约为5,Fe3+、Al3+转化为沉淀,高温下CaSO4•2H2O溶解度小,会析出晶体,过滤除去,所得到的滤渣主要成分是:Al(OH)3、Fe(OH)3、CaSO4•2H2O,
故答案为:高温下CaSO4•2H2O溶解度小;Al(OH)3、Fe(OH)3、CaSO4•2H2O;
(4)滤液Ⅱ中含有NaCl、硫酸镁,加入氢氧化钠溶液将镁离子转化为氢氧化镁沉淀,过滤分离,再加入足量的稀硫酸溶解氢氧化镁,将溶液蒸发浓缩、降温结晶、过滤、洗涤得硫酸镁晶体,
故答案为:NaOH溶液;向沉淀中加足量稀硫酸;
(5)设该盐泥中含Mg(OH)2的质量为x,MgSO4•7H2O质量为24.6克,
MgSO4•7H2O~Mg(OH)2
246 58
24.6g x
所以x=$\frac{24.6g×58}{246}$=5.8g
故该盐泥中含Mg(OH)2的百分含量为$\frac{5.8g}{29g}$×100%=20.0%,
故答案为:20.0%.
点评 本题考查物质的制备,涉及物质的分离和提纯、条件的控制、物质含量测定,注意根据问题理解工艺流程,较好的考查学生分析和解决问题的能力,题目综合性强,难度中等.

 优生乐园系列答案
优生乐园系列答案| A. | 1 mol磷酸钾中阴离子所带电荷数为NA | |
| B. | 在18g18O2中含有NA个18O原子 | |
| C. | 0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA | |
| D. | 将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个Na+ |
| A. | 1 mol NaCl 分子 | |
| B. | 质子数为 35、中子数为 45 的溴原子:${\;}_{35}^{45}$ Br | |
| C. | 硫离子的结构示意图: | |
| D. | NH4+ 的电子式: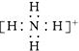 |
| A. | 元素R 位于周期表的IB 族,其原子序数为a,则原子序数为a-3 的元素位于ⅥB 族 | |
| B. | 在元素周期表中 114 号元素的上一周期同一族元素的原子序数是 82 | |
| C. | 具有相同电子层结构的主族元素离子为X2+、Y+,则最高价氧化物的水化物的碱性X>Y | |
| D. | 在周期表中金属与非金属的分界线处可以找到催化剂和耐高温、耐腐蚀的合金材料 |
| A. | 白、红、白 | B. | 红、黑、白 | C. | 红、红、红 | D. | 白、黑、白 |
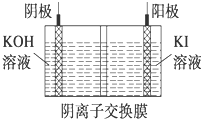 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.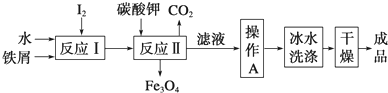
 .
. 、
、 .
.