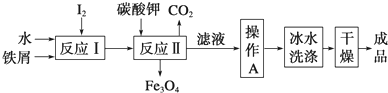
题目内容
9.某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,是一种常用的食品添加剂.该化合物具有如下性质:(i) 在25℃时,电离平衡常数K1=3.9×10-4,K2=5.5×10-6
(ii) A+RCOOH(或ROH)$→_{△}^{浓硫酸}$有香味的产物
(iii)1mol$\stackrel{足量的钠}{→}$慢慢产生1.5 mol气体
(iv) 核磁共振氢谱表明A分子中有5种不同化学环境的氢原子与A相关的反应框图如下:
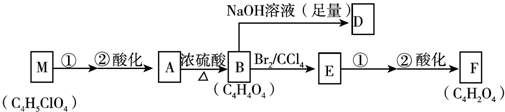
(1)根据化合物A的性质,对A的结构可作出的判断是bc.
(a)肯定有碳碳双键 (b)有两个羧基 (c)肯定有羟基 (d)有-COOR官能团
(2)写出A、F的结构简式:A:HOOCCH(OH)CH2COOH、F:HOOC-C≡C-COOH.
(3)写出A→B、B→E的反应类型:A→B消去反应、B→E加成反应.
(4)写出下列反应的反应条件:E→F第①步反应NaOH/醇溶液(或KOH/醇溶液)、加热.
(5)在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.写出该反应的化学方程式:nHOOC-CH═CH-COOH+nHOCH2CH2OH$→_{△}^{催化剂}$
 +(2n-1)H2O.
+(2n-1)H2O.(6)写出与A具有相同官能团的A的同分异构体的结构简式:
 .
.
分析 A中不饱和度=$\frac{4×2+2-6}{2}$=2,根据信息I知,A中含有两个羧基,A能和羧酸发生酯化反应生成酯,说明A中含有醇羟基,1molA与足量钠反应生成1.5mol氢气,结合I、II知含有1个醇羟基、两个羧基,核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,则A的结构简式为HOOCCH(OH)CH2COOH;
M中含有Cl原子,M先加成后取代然后酸化得到A,则M结构简式为HOOCCCl=CHCOOH,A在浓硫酸作催化剂、加热条件下反应生成B,根据B分子式知,A发生消去反应生成B,B结构简式为HOOCCH=CHCOOH;B和足量NaOH反应生成D,D为NaOOCCH=CHCOONa,B发生加成反应生成E,E为HOOCCHBrCHBrCOOH,E发生消去反应然后酸化得到F,根据F分子式知,F为HOOC-C≡C-COOH,据此分析解答.
解答 解:A中不饱和度=$\frac{4×2+2-6}{2}$=2,根据信息I知,A中含有两个羧基,A能和羧酸发生酯化反应生成酯,说明A中含有醇羟基,1molA与足量钠反应生成1.5mol氢气,结合I、II知含有1个醇羟基、两个羧基,核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,则A的结构简式为HOOCCH(OH)CH2COOH;
M中含有Cl原子,M先加成后取代然后酸化得到A,则M结构简式为HOOCCCl=CHCOOH,A在浓硫酸作催化剂、加热条件下反应生成B,根据B分子式知,A发生消去反应生成B,B结构简式为HOOCCH=CHCOOH;B和足量NaOH反应生成D,D为NaOOCCH=CHCOONa,B发生加成反应生成E,E为HOOCCHBrCHBrCOOH,E发生消去反应然后酸化得到F,根据F分子式知,F为HOOC-C≡C-COOH,
(1)A中不饱和度=$\frac{4×2+2-6}{2}$=2,根据信息I知,A中含有两个羧基,A能和羧酸发生酯化反应生成酯,说明A中含有醇羟基,1molA与足量钠反应生成1.5mol氢气,结合I、II知含有1个醇羟基、两个羧基,
故选bc;
(2)通过以上分析知,A、F的结构简式分别为:HOOCCH(OH)CH2COOH、HOOC-C≡C-COOH,
故答案为:HOOCCH(OH)CH2COOH;HOOC-C≡C-COOH;
(3)通过以上分析知,A→B、B→E的反应类型分别是消去反应、加成反应,
故答案为:消去反应;加成反应;
(4)通过以上分析知,E→F第①步反应是消去反应,反应条件是NaOH/醇溶液(或KOH/醇溶液),加热,
故答案为:NaOH/醇溶液(或KOH/醇溶液)、加热;
(5)B结构简式为HOOCCH=CHCOOH,在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物,该反应的化学方程式:nHOOC-CH═CH-COOH+nHOCH2CH2OH$→_{△}^{催化剂}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:nHOOC-CH═CH-COOH+nHOCH2CH2OH$→_{△}^{催化剂}$ +(2n-1)H2O;
+(2n-1)H2O;
(6)A的结构简式为HOOCCH(OH)CH2COOH,A的同分异构体与A具有相同官能团,说明含有醇羟基和羧基,符合条件的A的同分异构体的结构简式: ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确判断A结构简式是解本题关键,根据反应条件、分子式进行推断,知道常见有机反应类型及反应条件,难点是同分异构体种类判断.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 元素R 位于周期表的IB 族,其原子序数为a,则原子序数为a-3 的元素位于ⅥB 族 | |
| B. | 在元素周期表中 114 号元素的上一周期同一族元素的原子序数是 82 | |
| C. | 具有相同电子层结构的主族元素离子为X2+、Y+,则最高价氧化物的水化物的碱性X>Y | |
| D. | 在周期表中金属与非金属的分界线处可以找到催化剂和耐高温、耐腐蚀的合金材料 |
| A. | 白、红、白 | B. | 红、黑、白 | C. | 红、红、红 | D. | 白、黑、白 |
CH2=CHCOOH+HOCH3→CH2=CHCOOCH3+H2O
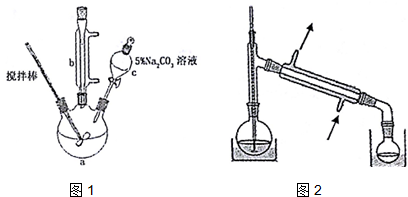
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10-00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验、防止明火.
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.
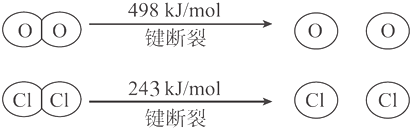
则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
| A. | 12kJ | B. | 32kJ | C. | 115.6kJ | D. | 127.6kJ |
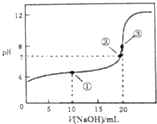 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | ①处水的电离程度大于②处水的电离程度 | |
| C. | ②处加入的NaOH溶液恰好将CH3COOH中和 | |
| D. | ③处所示溶液:c(Na+)<c(CH3COO-) |
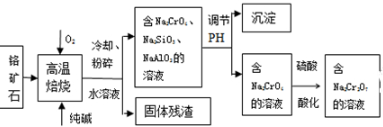
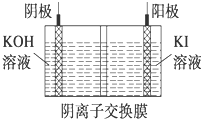 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.