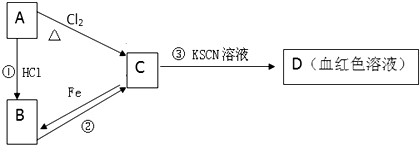
题目内容
14.英国研究人员发现,全球约有1.4亿人因为食用海带不当受到砷中毒之害,海带经水浸泡24小时后,其含砷量才能达到安全标准.已知砷为VA族元素,下列对砷(As)的有关判断中正确的是( )| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |
分析 As位于元素周期表中第四周期第ⅤA族,外围电子排布为4s24p3,同主族元素从上到下金属性增强,非金属性减弱,原子半径在增大,非金属性越强,气态氢化物越稳定,最高价氧化物的水化物的酸性越强,据此结合元素周期律知识解答.
解答 解:砷原子序数为33,As位于元素周期表中的第四周期第ⅤA族,Al位于ⅢA族,
A.非金属性As<P<S,非金属性越强,对应氢化物越稳定,则AsH3的热稳定性小于H2S,故A错误;
B.同主族元素从上到下原子半径在增大,则砷的原子半径大于磷的原子半径,故B错误;
C.非金属性越强,电负性越强,非金属性As<Br,则砷的电负性小于溴,故C错误;
D.砷的外围电子排布为4s24p3,砷原子的4p轨道含有3个未成对电子,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,涉及电负性、氢化物稳定性、原子半径的比较及原子核外电子排布规律,明确元素周期律内容为解答关键,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
2.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡与硫酸反应:OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| C. | 铁片插入硝酸银溶液中:Fe+Ag+=Fe2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
19. 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区 | |
| D. | 正极反应为:O2+4e-+2H2O=4OH- |
6.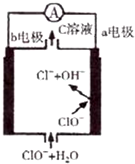 镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
 镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )| A. | 电池工作时,正极a附近的pH将不断增大 | |
| B. | 电池工作时,C溶液中的溶质是MgCl2 | |
| C. | 负极反应式:ClO-+2e-+H2O=Cl-+2OH- | |
| D. | b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl- |
3.下列化学变化需加入氧化剂才能发生的是( )
| A. | NO3-→NO2 | B. | Al(OH)3→AlO2- | C. | SO32-→SO2 | D. | Br-→Br2 |
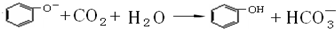 ,该反应说明苯酚具有的性质是弱酸性.
,该反应说明苯酚具有的性质是弱酸性.