题目内容
4.科学研究表明,月球上有丰富的He资源,可开发利用作未来的新型能源.(1)23He的中子数是1,23He与24He互称为同位素.
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有2个质子和2个中子.
(3)在23He、24He两种核素中,原子核内的中子数相差为1,与α粒子有相同质子数和中子数的是24He.
分析 (1)元素符号的左上角表示质量数,左下角表示质子数,中子数=质量数-质子数;具有相同质子数、不同中子数的原子互为同位素;
(2)核电荷数=质子数=核外电子数,质量数=质子数+中子数;
(3)中子数=质量数-质子数.
解答 解:(1)中子数=质量数-质子数=3-2=1;23He与24He具有相同质子数、不同中子数,互为同位素;
故答案为:1;同位素;
(2)α粒子是带2个单位正电荷,核电荷数=质子数=核外电子数=2,中子数=质量数-质子数=4-2=2;
故答案为:2;2;
(3)在23He、24He两种核素中,原子核内的中子数分别为1、2,中子数相差为1,24He具有2个质子,2个中子,与α粒子有相同质子数和中子数;
故答案为:1;24He.
点评 本题考查原子构成,注意原子由原子核和核外电子构成,其中原子核由质子和中子构成,注意原子序数=核内质子数=核外电子数=核电荷数是解题的关键,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
14.英国研究人员发现,全球约有1.4亿人因为食用海带不当受到砷中毒之害,海带经水浸泡24小时后,其含砷量才能达到安全标准.已知砷为VA族元素,下列对砷(As)的有关判断中正确的是( )
| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |
12.将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A. | H+、NH4+、Al3+、SO42- | B. | K+、SiO32-、Cl-、NO3- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Fe3+、CH3COO-、HCO3- |
19.甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
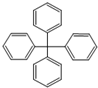

| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |
9.设NA为阿伏加德罗常数值.下列有关叙述不正确的是( )
| A. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA | |
| B. | 0.2 mol C2H6分子中一定存在0.2NA个碳碳单键 | |
| C. | 1 mol Fe溶于过量硝酸,电子转移数为3NA | |
| D. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA |
16.交通警察用经硫酸酸化处理的三氧化铬(CrO3)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中+6价铬能被酒精蒸气还原为+3价铬,颜色由红色变为绿色),可以判断司机是否酒后驾车.下列有关该反应原理的说法中正确的是( )
| A. | 三氧化铬作还原剂 | B. | 乙醇作还原剂 | ||
| C. | CrO3中Cr被氧化 | D. | 乙醇发生还原反应 |
13.下列说法正确的是( )
| A. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| B. | Na3N是离子化合物,溶于水后得到的溶液能使无色酚酞试液变红 | |
| C. | 2Na2O2+2H2O═4NaOH+O2↑,是水作还原剂的氧化还原反应 | |
| D. | 过氧化钠会因为与空气中的氧气反应而易变质 |
4.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙烷(乙烯):通入足量溴水 | |
| B. | 溴乙烷(乙醇):多次加入水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |