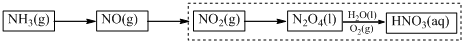题目内容
5.(1)苯酚与水混合,溶液变浑浊,向该浊液中滴加NaOH溶液,可观察到的现象是溶液变澄清反应的化学方程式为C6H5OH+NaOH→C6H5ONa+H2O,该反应说明苯酚具有酸性.(2)向上述溶液中通入CO2,可观察到的现象是溶液变浑浊,反应的离子方程式为
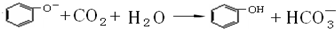 ,该反应说明苯酚具有的性质是弱酸性.
,该反应说明苯酚具有的性质是弱酸性.
分析 (1)C6H5OH与NaOH反应生成易溶于水的C6H5ONa,为中和反应;
(2)C6H5ONa溶液中通入CO2,生成苯酚沉淀.
解答 解:(1)苯酚与水混合,溶液变浑浊,向该浊液中滴加NaOH溶液,可观察到的现象是溶液变澄清,反应的化学方程式为C6H5OH+NaOH→C6H5ONa+H2O,该反应说明苯酚具有酸性,
故答案为:溶液变澄清;C6H5OH+NaOH→C6H5ONa+H2O;酸;
(2)向上述溶液中通入CO2,发生的离子反应为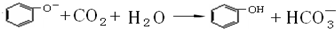 ,可观察到的现象是溶液变浑浊,该反应为强酸制取弱酸的反应,说明苯酚具有的性质是具有弱酸性,
,可观察到的现象是溶液变浑浊,该反应为强酸制取弱酸的反应,说明苯酚具有的性质是具有弱酸性,
故答案为:溶液变浑浊;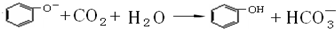 ;弱酸性.
;弱酸性.
点评 本题考查有机物的结构与性质,为高频考点,把握苯酚的酸性、强酸制取弱酸的原理等为解答的关键,侧重分析与应用能力的考查,注意酚的性质及应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.已知乙烯醇(CH2=CHOH)不稳定,可自动转化为乙醛;二元醇可脱水生成环状化合物,现有1mol乙二醇在一定条件下脱去1mol H2O,所得产物的结构简式有下列几种,其中不可能的是( )
①CH≡CH;②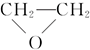 ③CH3CHO;④
③CH3CHO;④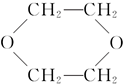 ⑤HO-CH2CH2OCH2CH2-OH.
⑤HO-CH2CH2OCH2CH2-OH.
①CH≡CH;②
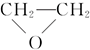 ③CH3CHO;④
③CH3CHO;④ ⑤HO-CH2CH2OCH2CH2-OH.
⑤HO-CH2CH2OCH2CH2-OH.| A. | 只有① | B. | 只有①④ | C. | 只有①⑤ | D. | ①②③④⑤ |
16.把V L含MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
| A. | $\frac{b-a}{V}$ mol•L-1 | B. | $\frac{2b-a}{V}$mol•L-1 | C. | $\frac{b-a}{V}$mol•L-1 | D. | $\frac{2(2b-a)}{V}$mol/L |
13.下列说法正确的是( )
| A. | 稳定性:H2S>HF | B. | HCl的电子式为H+Cl- | ||
| C. | 一个D2O分子所含的中子数为8 | D. | 酸性强弱:HClO4>H2SO4>H3PO4 |
10.如图是学校实验室从化学试剂商品店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L |
17.关于乙酸的酯化反应叙述正确的是( )
| A. | 属于氧化反应 | B. | 属于取代反应 | ||
| C. | 浓硫酸既是催化剂又是吸水剂 | D. | 用饱和的氯化钠溶液吸收乙酸乙酯 |
14.英国研究人员发现,全球约有1.4亿人因为食用海带不当受到砷中毒之害,海带经水浸泡24小时后,其含砷量才能达到安全标准.已知砷为VA族元素,下列对砷(As)的有关判断中正确的是( )
| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |