题目内容
19. 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区 | |
| D. | 正极反应为:O2+4e-+2H2O=4OH- |
分析 A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池;
C.原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区;
D.正极发生还原反应.
解答 解:A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故A正确;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故C正确;
D.正极的电极反应式为O2+4e-+4H+═2H2O,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,正确判断电解质溶液酸碱性是解本题关键,所有原电池中都是负极上失电子发生氧化反应、正极上得电子发生还原反应,难点是电极反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.如图是学校实验室从化学试剂商品店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L |
7.一定条件下硝酸铵受热分解的化学方程式为:3Cu+8HNO3=3Cu (NO3)2+2NO↑+4H2O,在反应中被还原与未被还原的氮原子数之比为( )
| A. | 8:3 | B. | 3:2 | C. | 1:3 | D. | 3:8 |
14.英国研究人员发现,全球约有1.4亿人因为食用海带不当受到砷中毒之害,海带经水浸泡24小时后,其含砷量才能达到安全标准.已知砷为VA族元素,下列对砷(As)的有关判断中正确的是( )
| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |
4.X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具行相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径:r(Z)<r(R) | |
| C. | R的氯化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |
9.设NA为阿伏加德罗常数值.下列有关叙述不正确的是( )
| A. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA | |
| B. | 0.2 mol C2H6分子中一定存在0.2NA个碳碳单键 | |
| C. | 1 mol Fe溶于过量硝酸,电子转移数为3NA | |
| D. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA |
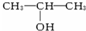 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.