题目内容
2.能正确表示下列化学反应的离子方程式的是( )| A. | 氢氧化钡与硫酸反应:OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| C. | 铁片插入硝酸银溶液中:Fe+Ag+=Fe2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
分析 A.漏掉了钡离子与硫酸根离子生成硫酸钡沉淀的反应;
B.CuO在离子方程式中不能拆开;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.二者反应生成氯化钙、二氧化碳气体和水.
解答 解:A. 氢氧化钡与硫酸反应生成硫酸钡、水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A错误;
B.氧化铜与盐酸反应生成氯化铜和水,正确的离子方程式为:CuO+2H+═Cu2++H2O,故B错误;
C.铁片插入硝酸银溶液中,发生置换反应,正确的离子方程式为:Fe+2Ag+=Fe2++2Ag,故C错误;
D.碳酸钙与盐酸中反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等;试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.在碱性溶液中能大量共存且为无色透明溶液的是( )
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、SiO32-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Mg2+、SO42-、NO3-、Cl- |
13.下列说法正确的是( )
| A. | 稳定性:H2S>HF | B. | HCl的电子式为H+Cl- | ||
| C. | 一个D2O分子所含的中子数为8 | D. | 酸性强弱:HClO4>H2SO4>H3PO4 |
10.如图是学校实验室从化学试剂商品店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L |
17.关于乙酸的酯化反应叙述正确的是( )
| A. | 属于氧化反应 | B. | 属于取代反应 | ||
| C. | 浓硫酸既是催化剂又是吸水剂 | D. | 用饱和的氯化钠溶液吸收乙酸乙酯 |
7.一定条件下硝酸铵受热分解的化学方程式为:3Cu+8HNO3=3Cu (NO3)2+2NO↑+4H2O,在反应中被还原与未被还原的氮原子数之比为( )
| A. | 8:3 | B. | 3:2 | C. | 1:3 | D. | 3:8 |
14.英国研究人员发现,全球约有1.4亿人因为食用海带不当受到砷中毒之害,海带经水浸泡24小时后,其含砷量才能达到安全标准.已知砷为VA族元素,下列对砷(As)的有关判断中正确的是( )
| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |
12.将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A. | H+、NH4+、Al3+、SO42- | B. | K+、SiO32-、Cl-、NO3- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Fe3+、CH3COO-、HCO3- |
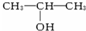 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.