题目内容
9.A、B、C、D四种物质都含有一种共同元素,A是常见的金属,在潮湿的空气中易生锈;C的溶液呈黄色,A、B、C、D有如图转化关系.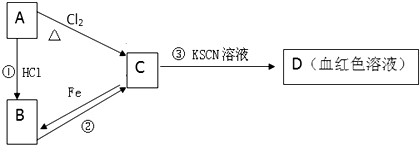
请回答下列问题:
(1)A是Fe,C是FeCl3.
(2)C的溶液与NaOH溶液混合后的现象是有红褐色沉淀生成.
(3)反应①的离子反应方程式Fe+2HCl=FeCl2+H2↑,反应类型是置换反应(选填:化合、分解、置换、复分解)
(4)A在潮湿的空气中易生锈,其锈的主要成份是Fe2O3,该锈的成份能与盐酸反应,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
分析 A是常见的金属,C的溶液呈现黄色,且C与KSCN溶液混合溶液为血红色,则C含有Fe3+,由元素守恒可知,A为Fe,结合转化关系可知,C为FeCl3,B为FeCl2,
(1)上述分析可知A为铁,C为氯化铁;
(2)氯化铁溶液和氢氧化钠反应生成红褐色沉淀氢氧化铁;
(3)反应①是铁和盐酸反应生成氯化亚铁和氢气的置换反应;
(4)Fe在潮湿的空气中易生锈,是因为杂质C和铁哎潮湿空气中发生电化腐蚀,生成铁锈成分为Fe2O3,氧化铁和盐酸反应生成氯化铁和水.
解答 解:A是常见的金属,C的溶液呈现黄色,且C与KSCN溶液混合溶液为血红色,则C含有Fe3+,由元素守恒可知,A为Fe,结合转化关系可知,C为FeCl3,B为FeCl2,
(1)由上述分析可知,A为Fe,C为FeCl3,
故答案为:Fe;FeCl3;
(2)C为FeCl3,与NaOH溶液反应为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,有红褐色沉淀生成,
故答案为:有红褐色沉淀生成;
(3)反应①为Fe+2HCl=FeCl2+H2↑,为置换反应,
故答案为:Fe+2HCl=FeCl2+H2↑,置换;
(4)Fe在潮湿的空气中易生锈,是因为杂质C和铁哎潮湿空气中发生电化腐蚀,生成铁锈成分为Fe2O3,氧化铁和盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O,
故答案为:Fe2O3,Fe2O3+6HCl=2FeCl3+3H2O.
点评 本题考查无机物的推断,C与KSC溶液呈血红色是推断的突破口,明确铁离子的颜色及检验方法是解答本题的关键,题目难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
13.结构简式为CH3(CH2)2C(CH3)2CH(CH3)2的有机物的一氯代物有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
17.关于乙酸的酯化反应叙述正确的是( )
| A. | 属于氧化反应 | B. | 属于取代反应 | ||
| C. | 浓硫酸既是催化剂又是吸水剂 | D. | 用饱和的氯化钠溶液吸收乙酸乙酯 |
4.下列化学反应中,属于氧化还原反应的是( )
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
14.英国研究人员发现,全球约有1.4亿人因为食用海带不当受到砷中毒之害,海带经水浸泡24小时后,其含砷量才能达到安全标准.已知砷为VA族元素,下列对砷(As)的有关判断中正确的是( )
| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |
1.据报道,月球上存在大量3He,以下有关3He的说法正确的是( )
| A. | 是4He的同分异构体 | B. | 比 4He少一个中子 | ||
| C. | 比4He少一个质子 | D. | 3He原子核有3个质子 |
18.下列各组物质中,表中a→b、b→c的相互转化不能一步完成的是( )
| a | b | c | |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | Fe | FeCl3 | Fe(OH)3 |
| D | Al(OH)3 | Na[Al(OH)4] | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
19.甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
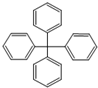

| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |