题目内容
5.某课外活动小组探究镁与CO2、NO2的反应.Ⅰ、实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体分别是C和MgO;该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测:
写出Mg在NO2中燃烧的化学方程式:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2.
反应产生的固体中可能存在Mg3N2物质(填化学式).
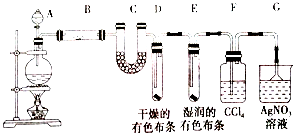
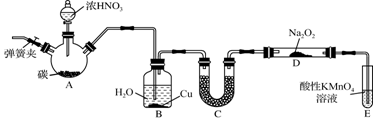
Ⅱ、设计实验验证以上猜测(用于连接玻璃管的乳胶管均内衬锡纸)

资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)写出A中发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)装置B中盛装的干燥剂是(填序号)②;
①浓硫酸 ②无水CaCl2 ③碱石灰
(3)实验开始时正确的操作步骤是badc;
a.打开A装置中分液漏斗的旋塞滴入浓硝酸制取NO2
b.打开活塞K
c.点燃C处酒精灯
d.当C处硬质玻璃管内充满红综色气体后,关闭活塞K
(4)D中NaOH溶液盛的很满,这样做的目的是使剩余NO2气体被NaOH溶液完全吸收;
(5)本实验中存在明显缺陷,改进措施是在活塞K处接一吸收NO2的尾气处理装置.
分析 I、(1)镁在二氧化碳气体中燃烧生成碳和氧化镁,Mg与NO2的反应类比Mg与CO2反应的思路写出;镁可和空气中的氮气反应生成氮化镁;
Ⅱ、A装置:铜和浓硝酸反应制取二氧化氮,B装置:干燥二氧化氮,C装置:镁和二氧化氮反应,D装置:吸收过量二氧化氮,E装置:排水法收集氮气,F装置:收集水.
(1)浓硝酸具有强氧化性,铜和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)装置B为U型干燥管,需盛放固体干燥剂,二氧化氮为酸性气体,需用酸性或中性干燥剂;
(3)应先在装置中充满二氧化氮气体再进行加热,按照此操作顺序进行连接;
(4)D装置:吸收过量二氧化氮,盛的很满,使剩余NO2气体被NaOH溶液完全吸收;
(5)二氧化氮为有毒气体,需进行尾气处理.
解答 解:I、(1)点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体为氧化镁和碳,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,类比Mg与CO2反应的思路,镁在二氧化氮气体中反应生成氧化镁和氮气,反应的化学方程式为:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2,镁可和空气中的氮气反应:3Mg+N2 $\frac{\underline{\;点燃\;}}{\;}$Mg3N2,反应产生的固体中可能存在Mg3N2,
故答案为:4Mg+2NO2$\frac{\underline{\;点燃\;}}{\;}$4MgO+N2;Mg3N2;
II、(1)浓硝酸具有强氧化性,能和较不活泼金属铜反应生成硝酸铜、二氧化氮和水,反应方程式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)装置B为U型干燥管,需盛放固体干燥剂,①浓硫酸为液体干燥剂,不符合,②无水CaCl2 为中性干燥剂,所以能干燥二氧化氮,③碱石灰为碱性干燥剂,不能干燥二氧化氮,
故答案为:②;
(3)应先在装置中充满二氧化氮气体再进行加热,防止空气的影响,所以实验顺序为badc,
故答案为:badc;
(4)依据反应2NO2+2NaOH=NaNO3+NaNO2+H2O分析,D中NaOH溶液主要吸收多余的二氧化氮气体,盛的很满,使剩余NO2气体被NaOH溶液完全吸收,
故答案为:使剩余NO2气体被NaOH溶液完全吸收;
(5)当C处硬质玻璃管内充满红综色气体后,关闭活塞K,部分二氧化氮会从K处逸出,二氧化氮为有毒气体,需进行尾气处理,存在明显缺陷,改进措施是在活塞K处接一吸收NO2的尾气处理装置,
故答案为:在活塞K处接一吸收NO2的尾气处理装置.
点评 本题考查物质性质实验的设计和实验验证方法和反应现象的分析判断,依据现象判断产物是解题关键,试题培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力,注意镁、氮及其化合物的性质,题目难度中等.

| A. | 压缩容器体积 | B. | 降温 | ||
| C. | 增大C(s)的量 | D. | 恒温恒压时加入一定量H2 |
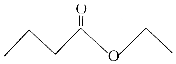 茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )
茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )| A. | X难溶于乙醇 | |
| B. | X的分子式为C6H10O2 | |
| C. | 酒中的少量丁酸能抑制X的水解 | |
| D. | 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体结构) |
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率低 | |
| C. | t1至t2时刻该反应的速率为3mo1•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | 实验1在前6min的平均反应速率υ(SO2)=0.2 mol•L-1•min-1 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | x=1.6,y=0.2,t<6 |
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| A. | A | B. | B | C. | C | D. | D |