题目内容
17.减小气态生成物的浓度,平衡正向移动,正反应速率减小,逆反应速率也减小√(判断对错)分析 减小气态生成物的浓度,瞬间逆反应速率减小,而正反应速率不变,则此时v(逆)<v(正),由此分析解答.
解答 解:减小气态生成物的浓度,瞬间逆反应速率减小,而正反应速率不变,则此时v(逆)<v(正),所以平衡正向移动,导到反应物的浓度减小,所以正反应速率也减小,故答案为:√.
点评 本题考查化学平衡移动的影响因素和化学反应速率的影响因素,难度中等,平衡移动的方向就分析条件改变后正逆反应速率的相对大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.某无色透明溶液能与铝粉反应放出H2,则此溶液中一定能大量共存的离子组是( )
| A. | Na+Cl-CO32- Cu2+ | B. | Na+Cl-K+ SO42- | ||
| C. | SO42- Mg2+ Ba2+ Cl- | D. | Na+Cl-K+ HCO3- |
12. 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A. | d点没有AgCl的不饱和溶液 | |
| B. | c点对应的Ksp 等于a点对应的Ksp | |
| C. | 加入AgNO3,可以使溶液由c点变到d点并保持不变 | |
| D. | 加入少量水,平衡右移,Cl- 浓度减小 |
2.下列说法正确的是( )
| A. | 人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能 | |
| B. | 化学反应不一定都有能量变化 | |
| C. | 活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响 | |
| D. | 活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响 |
9.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 减少CO2的排放,可以减少酸雨的产生 | |
| B. | 用SO2漂白纸浆和草帽辫,该过程发生了氧化还原反应 | |
| C. | 明矾净水的原理和“84”消毒液的原理不相同 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的主要材料是经提纯的SiO2 |
6.在相同条件下,取盐酸和醋酸溶液各100mL,与足量锌粉充分反应,若醋酸与锌反应放出的氢气多,则反应前( )
| A. | 两者H+浓度可能均为0.01 mol/L | |
| B. | 两者的浓度均为0.01 mol/L | |
| C. | 醋酸中H+浓度一定大于盐酸中H+浓度 | |
| D. | 盐酸浓度一定大于醋酸浓度 |
7.下列表示不正确的是( )
| A. | KOH的电子式: | B. | 二氧化碳的结构式:O=C=O | ||
| C. | CH4的球棍模型: | D. | S原子的结构示意图: |

 $→_{(ii)H_{2}O_{2}/OH-}^{(i)B_{2}H_{6}}$
$→_{(ii)H_{2}O_{2}/OH-}^{(i)B_{2}H_{6}}$
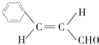 .
.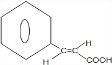 +(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+
+(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+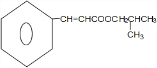 .
. .
.