题目内容
10.在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如表.据此判断下列结论正确的是( )| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率低 | |
| C. | t1至t2时刻该反应的速率为3mo1•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
分析 由表中数据可知达到t3时各物质的浓度不再发生改变,达到平衡状态,在t1~t4时刻△c(A):△c(B):△c(C)=(6-2):(5-3):(3-1)=4:2:2,则该反应的化学方程式为2A(g)+B(g)?C(g),以此解答该题.
解答 解:A.可逆反应达到了平衡状态,但是反应仍然进行,故A错误;
B.根据表中的数据,t1至t2,消耗了A3mol/L、B1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+B?C,反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B,故B错误;
C.反应速率之比等于系数之比,所以未指明是哪一种物质的反应速率,则无法计算,故C错误;
D.根据表中的数据,t1~t4时刻△c(A):△c(B):△c(C)=(6-2):(5-3):(3-1)=4:2:2,则该反应的化学方程式为2A(g)+B(g)?C(g),故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握表中数据的分析,把握平衡状态的特点,难度不大.

练习册系列答案
相关题目
7.符合化学式C7H8O的芳香族化合物的同分异构体有x种,能与金属钠反应放出H2的有y种,能与NaOH反应的有z种,则x、y、z分别是( )
| A. | 5,4,3 | B. | 4,4,3 | C. | 4,3,3 | D. | 3,3,3 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 6.2g白磷中所含P-P键的数目为0.15NA | |
| B. | 含H2O2 3.4克的溶液完全分解,其电子转移数目为NA | |
| C. | 117g氯化钠固体含有2NA个氯化钠分子 | |
| D. | 6克金刚石含NA个C-C键 |
15.一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH?(aq)下列说法正确的是( )
| A. | 恒温下向溶液中加入CaO,Ca2+离子数目减少 | |
| B. | 恒温下向溶液中加入CaO,溶液中C(Ca2+)减小 | |
| C. | 给溶液加热,溶液的pH不变 | |
| D. | 给溶液加热,溶液的离子浓度增大 |
2.下列说法正确的是( )
| A. | 人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能 | |
| B. | 化学反应不一定都有能量变化 | |
| C. | 活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响 | |
| D. | 活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响 |
19.根据题意回答下列问题:
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0,5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c=4.18×10-3kJ•g-1•℃-1,则该反应的中和热为△H=-55.7 kJ•mol-1.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏大(填“偏大”、“偏小”或“不变”).
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0,5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏大(填“偏大”、“偏小”或“不变”).
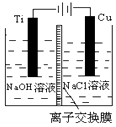 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法: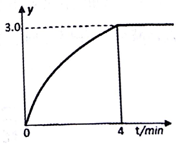

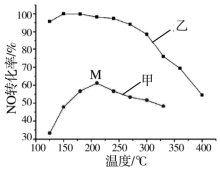 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0