题目内容
3.某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白性,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.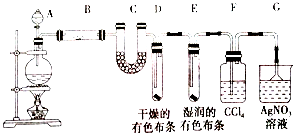
(1)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应.
(2)①装置B中盛放的试剂为无水硫酸铜,作用是白色固体变为蓝色.
②装置D和E中出现的不同现象说明的问题是干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性.
③装置F的作用是吸收氯气.
④写出装置G中发生主要反应的离子方程式为Ag++Cl-=AgCl↓.
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在F与G之间(填装置字母序号),装置中应放入湿润的淀粉KI试纸(或湿润的有色布条)(填写试剂或用品名称).
分析 加热条件下浓盐酸和二氧化锰发生氧化还原反应生成氯气,生成的氯气中含有氯化氢和水,B为硫酸铜,可用于检验水,C为氯化钙,可用于吸收水,D中干燥的有色布条不褪色,E中湿润的有色布条可褪色,F用于吸收氯气,G可用于检验氯化氢,溶液变浑浊,生成氯化银沉淀,因此解答该题.
解答 解:(1)浓盐酸与足量MnO2反应制取Cl2,反应消耗氯化氢,同时反应需要加热,浓盐酸易挥发而损害,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,
故答案为:加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应;
(2)①无水硫酸铜与水反应生成蓝色五水硫酸铜晶体,可用来检验水,
故答案为:无水硫酸铜;白色固体变为蓝色;
②D中干燥的布条不褪色,E中湿润的布条褪色说明干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性,
故答案为:干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性;
③氯气易溶于四氯化碳,用四氯化碳吸收氯气,防止干扰F中氯气中含有的氯化氢的检验,
故答案为:吸收氯气;
④F装置用来检验HCl气体,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓;
(3)氯气、氯化氢通入到硝酸银都会产生沉淀,为了确保实验结论的可靠性,应在装置E和F之间增加一个盛有湿润的淀粉碘化钾试纸或者湿润的有色布条,如果湿润的淀粉碘化钾试纸不变蓝或者湿润的有色布条不褪色,则氯气被完全吸收,
故答案为:F;G;湿润的淀粉KI试纸(或湿润的有色布条).
点评 本题考查性质实验方案的设计,题目难度中等,涉及了氯气的制备、氯气的性质、氯离子检验,明确实验的目的与原理是解题的关键,注意掌握氯气的化学性质及检验方法,试题侧重考查了学生的分析、理解能力及化学实验能力.

| A. | 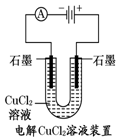 装置中阳极上析出红色固体 | |
| B. | 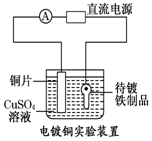 装置的待镀铁制品应与电源正极相连 | |
| C. | 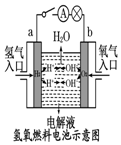 装置中外电路电子由a极流向b极 | |
| D. | 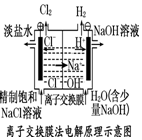 装置的阳极反应为:2H++2e-=H2↑ |
| A. | Na+Cl-CO32- Cu2+ | B. | Na+Cl-K+ SO42- | ||
| C. | SO42- Mg2+ Ba2+ Cl- | D. | Na+Cl-K+ HCO3- |
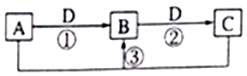 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |
| A. | NH3$\stackrel{O_{2}}{→}$NO2 $\stackrel{H_{2}O}{→}$HNO3 | B. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | ||
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | Na$\stackrel{O_{2}}{→}$ Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 |
| A. | 两者H+浓度可能均为0.01 mol/L | |
| B. | 两者的浓度均为0.01 mol/L | |
| C. | 醋酸中H+浓度一定大于盐酸中H+浓度 | |
| D. | 盐酸浓度一定大于醋酸浓度 |
 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:

 $→_{(ii)H_{2}O_{2}/OH-}^{(i)B_{2}H_{6}}$
$→_{(ii)H_{2}O_{2}/OH-}^{(i)B_{2}H_{6}}$
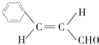 .
.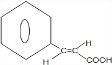 +(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+
+(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+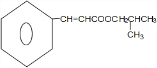 .
. .
.