题目内容
2.制取甲烷的反应为C(s)+2H2(g)?CH4(g)△H>0,欲提高反应的速率和H2的转化率,可采用的措施为( )| A. | 压缩容器体积 | B. | 降温 | ||
| C. | 增大C(s)的量 | D. | 恒温恒压时加入一定量H2 |
分析 提高反应的速率即可以升温、升压、增加浓度等;提高H2的转化率,可以使平衡正向进行,根据化学平衡移动原理来回答判断.
解答 解:A、压缩容器体积,反应速率加快且平衡向气体体积减小的正向移动,增大了反应物的转化率,故A正确;
B、降温反应速率减慢,故B错误;
C、增大固体C的物质的量对平衡移动和反应速率无影响,故C错误;
D、恒温恒压时加入一定量H2,氢气在转化率降低,故D错误;
故选A.
点评 本题考查化学反应速率、平衡移动原理的应用,属于基本知识的考查,注意知识的积累是解题的关键,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
12.下列说法正确的是( )
| A. | 电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离 | |
| B. | 电解质在通电时发生电离 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | NaCl和HCl都是电解质,所以它们熔融状态下都能导电 |
13.观察下列几个装置示意图,有关叙述正确的是( )
| A. | 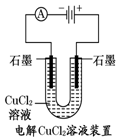 装置中阳极上析出红色固体 | |
| B. | 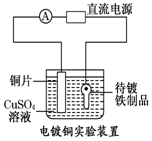 装置的待镀铁制品应与电源正极相连 | |
| C. | 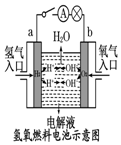 装置中外电路电子由a极流向b极 | |
| D. | 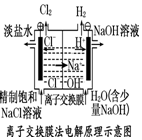 装置的阳极反应为:2H++2e-=H2↑ |
10.下列物质属于芳香烃,但不是苯的同系物的是( )


| A. | ③④ | B. | ②⑤ | C. | ①②⑤⑥ | D. | ②③④⑤⑥ |
17.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | Na2O、MgO、Fe3O4均为金属氧化物,并且都是碱性氧化物 | |
| B. | CH3COONa、CuSO4、NaOH、H2S水溶液均能导电,并且都是强电解质 | |
| C. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都含有铁元素,并且都是常见的铁矿石 | |
| D. | HClO、H2SO4、HNO3均具有氧化性,并且都是氧化性酸 |
7.符合化学式C7H8O的芳香族化合物的同分异构体有x种,能与金属钠反应放出H2的有y种,能与NaOH反应的有z种,则x、y、z分别是( )
| A. | 5,4,3 | B. | 4,4,3 | C. | 4,3,3 | D. | 3,3,3 |
14.某无色透明溶液能与铝粉反应放出H2,则此溶液中一定能大量共存的离子组是( )
| A. | Na+Cl-CO32- Cu2+ | B. | Na+Cl-K+ SO42- | ||
| C. | SO42- Mg2+ Ba2+ Cl- | D. | Na+Cl-K+ HCO3- |
11.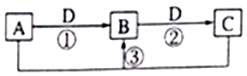 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |
