题目内容
5.将pH=1和pH=3的盐酸等体积混合,混合液的pH1.3;pH=12的Ba(OH)2溶液中由水电离产生的c (OH-)=10-12mol/L.分析 酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;Ba(OH)2溶液中,氢氧根几乎全部来自于氢氧化钡的电离,而氢离子全部来自于水的电离,而水电离出的c(OH-)=c(H+),据此分析.
解答 解:pH=1的盐酸和pH=3的盐酸等体积混合后,设体积均为VL,
混合液中氢离子的物质的量为:n(H+)=VL×10-1mol/L+VL×10-3mol/L=0.101Vmol,
则混合溶液中氢离子浓度为:c(H+)=$\frac{0.101Vmol}{2VL}$=5.05×10-2mol/L,
所以pH=-lg5.05×10-2=2-lg5.5=1.3;
pH=12的Ba(OH)2溶液中,氢氧根几乎全部来自于氢氧化钡的电离,而氢离子全部来自于水的电离,故水电离出的c(H+)=10-12mol/L,而水电离出的c(OH-)=c(H+)=10-12mol/L,即pH=12的Ba(OH)2溶液中由水电离产生的c(OH-)=10-12mol/L.
故答案为:1.3;10-12mol/L.
点评 本题考查了混合液的pH的计算,题目难度不大,试题侧重基础知识的考查,注意掌握pH的表达式及计算方法,明确溶液酸碱性与溶液pH的关系为解答关键,试题有利于培养学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
16.短周期元素A、B、C、D在周期表中的位置关系如图所示.已知在同周期元素的常见简单离子中,D的离子半径最小,E是周期表中半径最小的原子
回答下列问题:
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为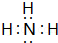 ,Y的结构式为
,Y的结构式为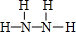
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
| A | B | C | |
| D |
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为

(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
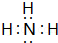 ,Y的结构式为
,Y的结构式为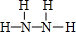
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
20.下列物质中,不属于卤代烃的是( )
| A. | 硝基苯 | B. | 溴苯 | C. | 四氯化碳 | D. | 氯乙烯 |
10.往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,待反应完成后过滤,可能存在的情况是( )
| A. | 滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+ | |
| B. | 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+ | |
| C. | 滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+ | |
| D. | 纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+ |
14.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
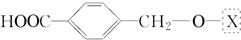 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. 任意2种.
任意2种.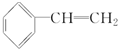 为主要原料制备
为主要原料制备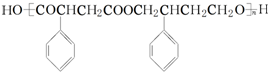 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).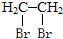
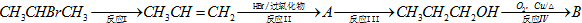 请回答下列问题:
请回答下列问题: