题目内容
15.已知A、B、C是中学化学常见物质,它们在一定条件下有如下转化关系
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”.则X的化学式为O2.
(2)若A一种黄绿色气体,X是生活中使用最广泛的一中金属.则B与金属Cu反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)若A是无色有刺激性气味的气体,B在空气中会立即转变为红棕色,则 A气体与X反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)如A是淡黄色固体,B是造成酸雨的“罪魁祸首”,则A为S单质,X为O2,B为SO2,C为SO3;
(2)若A一种黄绿色气体,X是生活中使用最广泛的一中金属,则A为Cl2,X为Fe,B为FeCl3,C为FeCl2;
(3)若A是无色有刺激性气味的气体,B在空气中会立即转变为红棕色,则A为NH3,X为O2,B为NO,C为NO2.
解答 解:(1)如A是淡黄色固体,B是造成酸雨的“罪魁祸首”,则A为S单质,X为O2,B为SO2,C为SO3,
故答案为:O2;
(2)若A一种黄绿色气体,X是生活中使用最广泛的一中金属,则A为Cl2,X为Fe,B为FeCl3,C为FeCl2,
则B与金属Cu反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)若A是无色有刺激性气味的气体,B在空气中会立即转变为红棕色,则A为NH3,X为O2,B为NO,C为NO2,A气体与X反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查无机物推断,着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,熟记中学常见连续反应.

练习册系列答案
相关题目
10.某化学兴趣小组发现实验室有多件表面呈灰绿色的金属制品,经了解其来源并查阅相关资料(如下表),初步确认为铜制品.
针对铜制品表面的灰绿色物质究竟是什么,同学们提出了多种猜想并展开实验探究.
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是青铜表面长出了铜绿(只写一个).
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是油漆是有机物,可燃.
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是青铜中含有金属锡,能与盐酸反应生成氢气.
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验.

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了白色固体变蓝色的现象,C中观察到了澄清石灰水变浑浊的现象.
B中所发生反应的化学方程式为:CuSO4+5H2O=CuSO4•5H2O.
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是无法确定分解产物中是否有水.
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:Cu2(OH)2CO3+8NH3•H2O=2Cu(NH3)42++2OH-+CO32-+8H2O.
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |
【猜想假设】
(1)小吴同学认为可能是纯铜制品表面涂上了灰绿色的油漆;
小周同学认为可能是青铜(铜锡合金),因为常见的青铜是灰绿色的;
小黄同学认为是纯铜制品,只是表面长出了铜绿[Cu2(OH)2CO3];
除上述猜想外,其他合理的猜想是青铜表面长出了铜绿(只写一个).
【实验验证】三位同学为了验证各自上述的猜想,进行了以下探究:
(2)小吴刮下部分灰绿色物质放入燃烧匙中进行灼烧,发现该物质不能燃烧,证明灰绿色物质不是油漆.其判断依据是油漆是有机物,可燃.
(3)小周刮下足量的灰绿色物质投入盐酸溶液中,观察到有气体产生,实验表明该气体不能燃烧.将表面刮净后的铜制品也投入盐酸中,并无气体产生.由此证明该铜制品不是青铜,理由是青铜中含有金属锡,能与盐酸反应生成氢气.
(4)根据上述实验,小黄认为灰绿色物质可能是铜绿[Cu2(OH)2CO3].于是按如图所示装置进行实验.

实验证明小黄的猜测是正确的,因为在A中观察到灰绿色物质变黑,B中观察到了白色固体变蓝色的现象,C中观察到了澄清石灰水变浑浊的现象.
B中所发生反应的化学方程式为:CuSO4+5H2O=CuSO4•5H2O.
如果将实验装置中的B和C进行调换,将无法得出灰绿色物质是铜绿的结论,原因是无法确定分解产物中是否有水.
【实验拓展】
(5)小黄同学还从网上找到了利用氨水擦拭去除铜绿的方法,其原理是氨水与碱式碳酸铜反应生成铜氨络离子[Cu(NH3)42+],其离子方程式可表示为:Cu2(OH)2CO3+8NH3•H2O=2Cu(NH3)42++2OH-+CO32-+8H2O.
20.化合物 与NaOH溶液、碘水三者混和后可发生如下反应:
与NaOH溶液、碘水三者混和后可发生如下反应:
①I2+2NaOH=NaI+NaIO+H2O
②
③
此反应称为碘仿反应,根据上述反应方程式推断下列物质中能发生碘仿反应的有( )
 与NaOH溶液、碘水三者混和后可发生如下反应:
与NaOH溶液、碘水三者混和后可发生如下反应:①I2+2NaOH=NaI+NaIO+H2O
②

③

此反应称为碘仿反应,根据上述反应方程式推断下列物质中能发生碘仿反应的有( )
| A. | CH3CHO | B. | CH3CH2CHO | ||
| C. | CH3CH2COCH2CH3 | D. | CH3CH2COCH2 CH2CH3 |
7.某有机物的结构简式为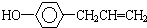 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
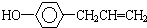 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 该有机物所有原子均可在同一平面上 | |
| B. | 1mol该有机物最多可与4mol溴发生反应 | |
| C. | 该有机物核磁共振氢谱有6组峰,峰面积比为1:1:2:2:2:2 | |
| D. | 该有机物在水中的溶解度大于苯酚在水中的溶解度 |
4.将过量CO2的通入下列溶液中,出现浑浊的是( )
| A. | CaCl2溶液 | B. | 石灰水 | C. | 饱和Na2CO3 | D. | 硅酸钠溶液 |
5.下列实验操作、现象和结论有错误的是( )
| 操作 | 现象 | 结论 | |
| A | 向试管中的无色溶液内滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 不能确定原溶液中是否含有NH4+ |
| B | 加热盛有铜与浓硫酸的试管,发现试管底部出现白色固体,直接向试管中加入适量水 | 白色固体溶解,溶液变蓝色 | 白色固体为无水硫酸铜 |
| C | 将稀硫酸酸化的H2O2溶液滴入FeCl2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向蔗糖中加入浓硫酸,并不断用玻璃棒搅拌 | 变黑,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
