题目内容
把6.72L NO2气体,依次通过下列3个分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集到集气瓶中并得到200mL溶液,下列说法错误的是(气体体积均在标况下测定)( )
| A、最后所得溶液的物质的量浓度是0.33mol/L |
| B、通过装置①②后气体体积仍为6.72L |
| C、通过装置③后所得气体呈红棕色 |
| D、集气瓶中收集到0.025mol O2 |
考点:化学方程式的有关计算
专题:计算题
分析:6.72L NO2气体,二氧化氮体积=
=0.03mol,依次通过下列3个分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,①发生的反应分别为:3NO2+H2O=2HNO3+NO、HNO3+NaHCO3=NaNO3+H2O+CO2↑,通过①后NO的体积=
×6.72L=2.24L,二氧化碳体积=0.02mol×22.4L/mol=4.48L,
②中浓硫酸干燥二氧化碳、NO气体,③中发生的反应为2CO2+Na2O2=2Na2CO3+O2,生成氧气的体积=1.12L,所以NO、氧气的体积之比为2.24L:1.12L=2:1,则氧气过量,发生的反应为4NO+3O2+2H2O=4HNO3,所以最终剩余的气体是氧气,
A.根据NO的物质的量计算硝酸的浓度;
B.通过装置①②后剩余气体是NO和二氧化碳,根据二氧化氮体积计算NO体积、根据硝酸计算二氧化碳体积;
C.通过装置③后,NO和氧气反应生成二氧化氮;
D.根据氧气和NO之间的关系式计算最终生成气体成分.
| 6.72L |
| 22.4L/mol |
| 1 |
| 3 |
②中浓硫酸干燥二氧化碳、NO气体,③中发生的反应为2CO2+Na2O2=2Na2CO3+O2,生成氧气的体积=1.12L,所以NO、氧气的体积之比为2.24L:1.12L=2:1,则氧气过量,发生的反应为4NO+3O2+2H2O=4HNO3,所以最终剩余的气体是氧气,
A.根据NO的物质的量计算硝酸的浓度;
B.通过装置①②后剩余气体是NO和二氧化碳,根据二氧化氮体积计算NO体积、根据硝酸计算二氧化碳体积;
C.通过装置③后,NO和氧气反应生成二氧化氮;
D.根据氧气和NO之间的关系式计算最终生成气体成分.
解答:
解:6.72L NO2气体,二氧化氮体积=
=0.03mol,依次通过下列3个分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,①发生的反应分别为:3NO2+H2O=2HNO3+NO、HNO3+NaHCO3=NaNO3+H2O+CO2↑,通过①后NO的体积=
×6.72L=2.24L,二氧化碳体积=0.02mol×22.4L/mol=4.48L,
②中浓硫酸干燥二氧化碳、NO气体,③中发生的反应为2CO2+Na2O2=2Na2CO3+O2,生成氧气的体积=1.12L,所以NO、氧气的体积之比为2.24L:1.12L=2:1,则氧气过量,发生的反应为4NO+3O2+2H2O=4HNO3,所以最终剩余的气体是氧气,
A.NO的物质的量是0.01mol,则硝酸的物质的量浓度=
=0.01mol/L,故A错误;
B.通过装置①②后剩余气体是NO和二氧化碳,则混合气体体积=2.24L+4.48L=6.72L,故B正确;
C.通过装置③后,NO和氧气反应生成二氧化氮,所以通过装置③后所得气体呈红棕色,故C正确;
D.NO的物质的量是0.01mol,氧气的物质的量是0.005mol,根据4NO+3O2+2H2O=4HNO3,得氧气剩余,剩余氧气的物质的量=0.005mol-
×3=0.025mol,故D正确;
故选A.
| 6.72L |
| 22.4L/mol |
| 1 |
| 3 |
②中浓硫酸干燥二氧化碳、NO气体,③中发生的反应为2CO2+Na2O2=2Na2CO3+O2,生成氧气的体积=1.12L,所以NO、氧气的体积之比为2.24L:1.12L=2:1,则氧气过量,发生的反应为4NO+3O2+2H2O=4HNO3,所以最终剩余的气体是氧气,
A.NO的物质的量是0.01mol,则硝酸的物质的量浓度=
| ||
| 3.92L |
B.通过装置①②后剩余气体是NO和二氧化碳,则混合气体体积=2.24L+4.48L=6.72L,故B正确;
C.通过装置③后,NO和氧气反应生成二氧化氮,所以通过装置③后所得气体呈红棕色,故C正确;
D.NO的物质的量是0.01mol,氧气的物质的量是0.005mol,根据4NO+3O2+2H2O=4HNO3,得氧气剩余,剩余氧气的物质的量=0.005mol-
| 0.01mol |
| 4 |
故选A.
点评:本题考查了根据方程式的计算,明确该过程中发生的反应是解本题关键,再结合物质之间的关系式进行计算解答,计算量较大,题目难度中等.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
在某一化学反应A+2B?3C中,生成物B的浓度在10s内从1.5mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为( )
| A、0.05mol/(L?s) |
| B、0.05mol/L |
| C、0.033 mol/(L?s) |
| D、0.075 mol/(L?s) |
下列反应中既属于氧化还原反应,又属于吸热反应的是( )
A、C(石墨)=C(金刚石),在该反应进程中其能量变化如下图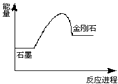 |
| B、Ba(OH)2?8H2O与NH4Cl反应 |
| C、灼热的碳与CO2反应 |
| D、甲烷在氧气中燃烧 |
20mL 0.1mol/L溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液.已知:Kaq=[Fe(OH)3]=4.0×10-38,Kaq=[Fe(OH)2]=8.0×10-16.( )
| A、沉淀中只有Fe(OH)3 |
| B、沉淀中有Fe(OH)3和Fe(OH)2 |
| C、滤液c(Fe3+)=4.0×10-8mol/L |
| D、向滤液中滴加FeCl2溶液,无沉淀产生 |
下列四组物质,其中互为同分异构体的是( )
①苯和甲苯 ②1-丁炔和1,3-丁二烯 ③乙醇和乙二醇 ④乙烯和聚乙烯.
①苯和甲苯 ②1-丁炔和1,3-丁二烯 ③乙醇和乙二醇 ④乙烯和聚乙烯.
| A、①② | B、② | C、①③ | D、②③④ |
下列离子方程式中正确的是( )
| A、NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO4_2-=BaSO4↓+2H2O |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| C、次氯酸钠溶液中通入SO2气体:2ClO-+SO2+H2O═2HClO+SO42- |
| D、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
下列描述的一定是金属元素的是( )
| A、易失去电子的物质 |
| B、能与酸反应的物质 |
| C、原子最外电子层只有一个电子的元素 |
| D、原子核内有11个质子的元素 |