题目内容
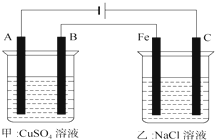 如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答:
如图为相互串联的甲、乙两个电解池(电极A、B、C都是惰性电极),请回答:(1)写出甲电解池中的电解反应化学方程式
(2)乙池中C电极的电极反应式为
若将C电极换为铜电极则电极反应式为
(3)若利用甲装置实现铁上镀铜,则金属铜应放在
考点:电解原理
专题:电化学专题
分析:(1)甲电解池中,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,据此写出电池反应式;
(2)乙槽中,阳极C上氯离子放电,阴极Fe上氢离子放电,将C电极换为铜电极,阳极为铜失电子生成铜离子;
(3)利用甲装置实现铁上镀铜,阳极镀铜原理阳极B为纯铜,A为阴极是铁,阳极电极反应和电子守恒计算乙池中阴极铁电极上生成气体体积.
(2)乙槽中,阳极C上氯离子放电,阴极Fe上氢离子放电,将C电极换为铜电极,阳极为铜失电子生成铜离子;
(3)利用甲装置实现铁上镀铜,阳极镀铜原理阳极B为纯铜,A为阴极是铁,阳极电极反应和电子守恒计算乙池中阴极铁电极上生成气体体积.
解答:
解:(1)甲装置中,电极都是惰性电极,所以电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(2)乙槽中,阳极C上氯离子放电,电极反应为:2Cl--2e-=Cl2↑,阴极Fe上氢离子放电,将C电极换为铜电极,阳极为铜失电子生成铜离子:Cu-2e-=Cu2+;
故答案为:2Cl--2e-=Cl2↑;Cu-2e-=Cu2+;
(3)利用甲装置实现铁上镀铜,阳极镀铜原理阳极B为纯铜,A为阴极是铁,当电极上析出12.8gCu时,铜的物质的量=
=0.2mol,电极反应Cu2++2e-=Cu,电子转移0.4mol,乙池中Fe电极上电极反应:2H++2e-=H2↑,产生的气体在标准状况下的体积0.2mol,体积=0.2mol×22.4L/mol=4.48L=4480ml,
故答案为:B;4480.
| ||
| ||
(2)乙槽中,阳极C上氯离子放电,电极反应为:2Cl--2e-=Cl2↑,阴极Fe上氢离子放电,将C电极换为铜电极,阳极为铜失电子生成铜离子:Cu-2e-=Cu2+;
故答案为:2Cl--2e-=Cl2↑;Cu-2e-=Cu2+;
(3)利用甲装置实现铁上镀铜,阳极镀铜原理阳极B为纯铜,A为阴极是铁,当电极上析出12.8gCu时,铜的物质的量=
| 12.8g |
| 64g/mol |
故答案为:B;4480.
点评:本题考查电解原理及利用电子守恒的计算,明确阴阳极的判断及发生的电极反应是解答本题的关键,难度中等.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
50mL 0.1mol/L FeCl3溶液与25mL 0.2mol/L KCl溶液中的Cl-的数目之比( )
| A、5:2 | B、3:1 |
| C、2:5 | D、1:3 |
在某一化学反应A+2B?3C中,生成物B的浓度在10s内从1.5mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为( )
| A、0.05mol/(L?s) |
| B、0.05mol/L |
| C、0.033 mol/(L?s) |
| D、0.075 mol/(L?s) |
20mL 0.1mol/L溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液.已知:Kaq=[Fe(OH)3]=4.0×10-38,Kaq=[Fe(OH)2]=8.0×10-16.( )
| A、沉淀中只有Fe(OH)3 |
| B、沉淀中有Fe(OH)3和Fe(OH)2 |
| C、滤液c(Fe3+)=4.0×10-8mol/L |
| D、向滤液中滴加FeCl2溶液,无沉淀产生 |
有aXm+和bYn-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A、b-a=n+m |
| B、a-b=n+m |
| C、核电荷数Y=X |
| D、核电荷数Y>X |
 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题: