题目内容
9.分子结构中没有环的烷烃称为开链烷烃.通式是CnH2n+2(n是正整数),其分子中每减少2个碳氢键,必增加一个碳碳键(它可能是双键或叁键,也可能是环烃),可称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”),假如若干烃类分子和烃基的不饱和度如下:①CH3CH2CH2CH3,Ω=0;②(CH3)2CH-,Ω=0;③CH2=CHCH2-,Ω=1;④
 Ω=4;⑤
Ω=4;⑤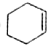 Ω=2;⑥
Ω=2;⑥ Ω=4.
Ω=4.现有下列烃A、B、C,根据要求完成以下各题:
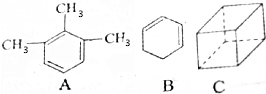
(1)烃A的分子内处于同一平面上碳原子数为9个,其不饱和度Ω=4;
(2)关于烃B的说法错误的是BD(填写编号)
A.有机物B能使酸性KMnO4溶液褪色
B.分子内含有两种官能团
C.B分子的不饱和度Ω=3
D.有机物B与等摩尔Br2发生加成反应只能得到一种产物
(3)烃C的分子式为C8H8,其不饱和度Ω=5,烃C的二氯取代物有3种,与烃C互为同分异构体且属于芳香烃的结构简式为C6H5-C2H5.
分析 (1)A相当于是用3个甲基取代了苯环上的3个H原子;根据每减少2个碳氢键,增加了1个不饱和度以及A的分子式为C9H12来分析;
(2)B的官能团为两条双键,据此分析其的不饱和度和所能发生的反应;
(3)键线式中每个拐点和端点均代表一个碳原子,而碳原子能形成4条价键,其余的用氢原子补充;根据其分子式来计算其不饱和度;烃的二氯代物的同分异构体可以采用固定一个氯原子的方法来寻找;
解答 解:(1)A相当于是用3个甲基取代了苯环上的3个H原子,而苯中的12个原子共平面,故A中的这9个碳原子全部共平面;根据每减少2个碳氢键,增加了1个不饱和度以及A的分子式为C9H12可知不饱和度Ω=$\frac{2×9+2-12}{2}$=4,故答案为:9;4;
(2)B的官能团为两条双键.
A、由于B中含碳碳双键,故能使高锰酸钾溶液褪色,故A正确;
B、官能团只有一种,即碳碳双键,故B错误;
C、结构中含两条碳碳双键,并形成了环,故比相同碳原子数的烷烃少6个H原子,即为3个不饱和度,故C正确;
D、有机物B与等摩尔Br2发生加成反应,可以发生1,2-加成,也可以发生1,4-加成,故产物有两种,故D错误.
故选BD.
(3)键线式中每个拐点和端点均代表一个碳原子,而碳原子能形成4条价键,其余的用氢原子补充,故C的分子式为C8H8,其不饱和度=$\frac{2×8+2-8}{2}$=5;其二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以C的二氯代物的同分异构体有3种;与烃C互为同分异构体且属于芳香烃的结构简式为C6H5-C2H5.故答案为:C8H8;5;3;C6H5-C2H5.
点评 本题考查了不饱和度的概念和计算以及有机物性质的判断,应注意有机物的性质取决于其含有的官能团,难度不大.

 名校课堂系列答案
名校课堂系列答案 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.

 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.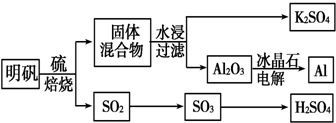

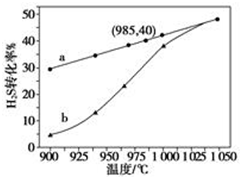 在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.
在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.