题目内容
10.某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等.某实验小组利用其提取Al(OH)3.
(1)“酸浸”过程中发生的主要反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(2)滤渣Ⅱ的主要成分是CaCO3、Mg(OH)2和Fe(OH)3.
(3)①上述流程中可循环利用的物质的化学式是CO2(或Na2CO3).②“转化”时主要反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-).
分析 煤矸石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,然后过滤,得到的滤渣为SiO2,向滤液中通入氯气,发生的反应为2Fe2++Cl2=2Cl-+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、CO32-+Ca2+=CaCO3↓、Mg2++2H2O?Mg(OH)2+2H+、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,滤液II中含有NaHCO3或碳酸钠,以此解答该题.
解答 解:煤矸石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,然后过滤,得到的滤渣为SiO2,向滤液中通入氯气,发生的反应为2Fe2++Cl2=2Cl-+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、CO32-+Ca2+=CaCO3↓、Mg2++2H2O?Mg(OH)2+2H+、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,滤液II中含有NaHCO3或碳酸钠,
(1)酸浸过程中金属氧化物都和稀盐酸反应生成氯化物,主要离子反应方程式为Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)通过以上分析知,滤渣II的成分为CaCO3、Mg(OH)2和Fe(OH)3,故答案为:Fe(OH)3;
(3)①水解时生成二氧化碳气体、转化时需要二氧化碳,在水解是需要碳酸钠、在转化时得到碳酸氢钠或碳酸钠,所以能循环利用的是CO2(或Na2CO3),
故答案为:CO2(或Na2CO3);
②通过以上分析知,转化时发生的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-).
点评 本题考查制备实验方案设计,为高考高频点,此种题型涉及物质性质、实验基本操作,明确物质的性质及每一步发生的反应、基本操作方法是解本题关键,熟练掌握元素化合物知识,灵活运用知识解答问题,题目难度中等.

| A. | F | B. | Cl | C. | Al | D. | I |
(1)常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子.A离子的结构示意图为
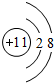 .
.(2)写出E2J4与水反应的化学方程式CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;其反应类型为加成反应.
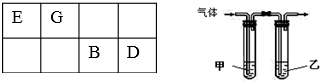
(3)利用右图装置设计一简单实验证明元素非金属性D>B.甲中应盛放某种弱电解质的溶液,其溶质的化学式为H2S,所通入气体与乙中某强电解质溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)元素D的最高价氧化物为无色液体,0.20mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量,该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol.
(5)G的最简单氢化物溶于水得溶液X,D的氢化物溶于水得溶液Y.常温下,将X、Y等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
②组混合溶液中各离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(1)酸式滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测得的结果偏高(填“偏高”、“偏低”或“无影响”).
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(1)已知常温下,几种弱酸的电离常数如表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
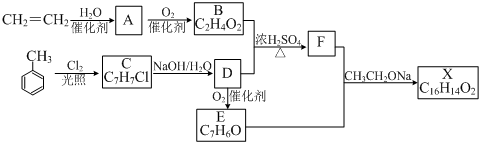
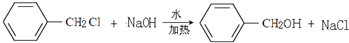 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.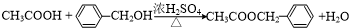 .
.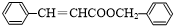 .
.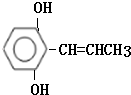 .
. Ω=4;⑤
Ω=4;⑤ Ω=2;⑥
Ω=2;⑥ Ω=4.
Ω=4.

