题目内容
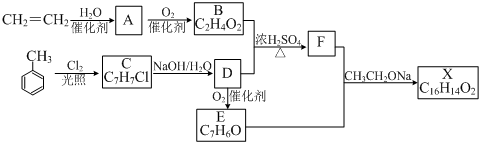
17.H的合成路线如图所示:
已知:①G是烃的含氧衍生物;②1molG能与3molNa反应生成无色气体,能与2mol的NaHCO3溶液反应并产生CO2气体,发生脱水反应能产生使溴水褪色的产物.
(1)D中含有的官能团的名称为醛基、溴原子,D中的Br原子在C→E反应中的作用是防止碳碳双键被氧化,同时为引入羟基做准备.
(2)与G具有相同官能团的同分异构体有2种,其中在PMR中有三个吸信号,其强度之比为3:2:1的结构简式为HOOCC(OH)(CH3)COOH
(3)1-戊烯与水加成反应后所得同分异构体中能被氧化成醛的有机物有4种.
(4)H为G的聚合物,具有良好的生物相溶性,请写出H在生物体内水解的化学方程式
 +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.
分析 G的分子式为C4H6O5,l molG与与2mol的NaHCO3溶液反应并产生CO2气体,而G中含有2个-COOH,1molG能与3molNa反应生成无色气体,说明G中还含有1个-OH,G发生脱水反应能产生使溴水褪色的产物,则G的结构简式为:HOOCCH2CH(OH)COOH.H是一种高分子化合物,则G发生缩聚反应得到H,H的结构简式为: .D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D,据此解答.
.D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D,据此解答.
解答 解:G的分子式为C4H6O5,l molG与与2mol的NaHCO3溶液反应并产生CO2气体,而G中含有2个-COOH,1molG能与3molNa反应生成无色气体,说明G中还含有1个-OH,G发生脱水反应能产生使溴水褪色的产物,则G的结构简式为:HOOCCH2CH(OH)COOH.H是一种高分子化合物,则G发生缩聚反应得到H,H的结构简式为: .D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D.
.D被氧化生成E,则E中含有溴原子,E和氢氧化钠的水溶液发生水解反应生成F,F酸化生成G,所以F的结构简式为:NaOOCCH2CH(OH)COONa,E的结构简式为:HOOCCH2CHBrCOOH,D能发生银镜反应则D中含有醛基,所以D的结构简式为:OHCCH2CHBrCHO,根据1,3-丁二烯及D的结构简式知,1,3-丁二烯和溴发生1,4-加成生成A为BrCH2CH=CHCH2Br,A和氢氧化钠的水溶液发生取代反应生成B为HOCH2CH=CHCH2OH,B与HBr发生加成反应生成C,C的结构简式为:HOCH2CH2CHBrCH2OH,C再被氧化生成D.
(1)由上述分析可知,D为OHCCH2CHBrCHO,含有官能团有:醛基、溴原子,D中的Br原子在C→E反应中可以防止碳碳双键被氧化,同时为引入羟基做准备,
故答案为:醛基、溴原子;防止碳碳双键被氧化,同时为引入羟基做准备;
(2)G的结构简式为:HOOCCH2CH(OH)COOH,与G具有相同官能团的同分异构体有HOOCCH(CH2OH)COOH、HOOCC(OH)(CH3)COOH,共2种,其中在PMR中有三个吸信号,其强度之比为3:2:1的结构简式为HOOCC(OH)(CH3)COOH,
故答案为:2;HOOCC(OH)(CH3)COOH;
(3)1-戊烯与水加成反应后所得的产物分子式为C5H12O,其同分异构体中能被氧化成醛的,即有-CH2OH结构的有机物为CH3CH2CH2CH2CH2OH、CH3CH2CH(CH3)CH2OH、CH3CH(CH3)CH2CH2OH、(CH3)3CCH2OH,共有4种,
故答案为:4;
(4)H在生物体内水解方程式为: +(n-1)H2O→n HOOCCH2CH(OH)COOH,
+(n-1)H2O→n HOOCCH2CH(OH)COOH,
故答案为: +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.
点评 本题考查有机物的推断与合成,确定G的结构简式解答本题的关键,再结合转化关系进行推断,需要学生熟悉掌握官能团的性质与演变,题目难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
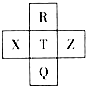 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>Q |
(1)常见发酵粉、加碘盐、味精及某些食品防腐剂的主要成分都含有金属元素A的离子.A离子的结构示意图为
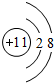 .
.(2)写出E2J4与水反应的化学方程式CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;其反应类型为加成反应.
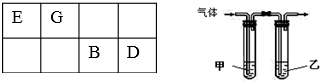
(3)利用右图装置设计一简单实验证明元素非金属性D>B.甲中应盛放某种弱电解质的溶液,其溶质的化学式为H2S,所通入气体与乙中某强电解质溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)元素D的最高价氧化物为无色液体,0.20mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量,该反应的热化学方程式为Cl2O7(l)+H2O(l)=HClO4(aq)△H=-QkJ/mol.
(5)G的最简单氢化物溶于水得溶液X,D的氢化物溶于水得溶液Y.常温下,将X、Y等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
②组混合溶液中各离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| C. | 由a点到b点的过程中,溶液中C(H+):C(ClO-)减小 | |
| D. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
 4-甲基-1-戊炔
4-甲基-1-戊炔 3,3,4=三甲基己烷.
3,3,4=三甲基己烷.
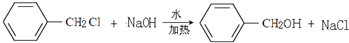 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.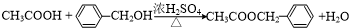 .
.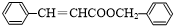 .
. .
. Ω=4;⑤
Ω=4;⑤ Ω=2;⑥
Ω=2;⑥ Ω=4.
Ω=4.