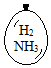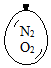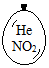题目内容
15.CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标.250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g)(1)此温度下该反应的平衡常数表达式K=$\frac{[CO]^{2}•[{H}_{2}]^{2}}{[C{O}_{2}]•[C{H}_{4}]}$.
(2)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
③2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1;
(3)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式CH4-8e-+10OH-=CO32-+7H2O.
分析 (1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积回答;
(2)已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得CO2(g)+CH4(g)?2CO(g)+2H2(g)△,据此计算;
(3)甲烷在原电池的负极发生氧化反应,在碱性环境中生成碳酸根离子,据此分析.
解答 解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数表达式为K=$\frac{[CO]^{2}•[{H}_{2}]^{2}}{[C{O}_{2}]•[C{H}_{4}]}$;
故答案为:$\frac{[CO]^{2}•[{H}_{2}]^{2}}{[C{O}_{2}]•[C{H}_{4}]}$;
(2)已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1,
故答案为:+247.3;
(3)甲烷在原电池的负极失电子发生氧化反应,在碱性环境中生成碳酸根离子,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O.
点评 本题主要考查了化学反应平衡常数表达式、盖斯定律的应用、电极反应式的书写,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 常用铁锅炒菜比常用铝锅好 | B. | 遇氯气泄漏人应顺风向低处跑 | ||
| C. | 用食醋除去水壶中的水垢 | D. | 铁粉作食品袋内的脱氧剂 |
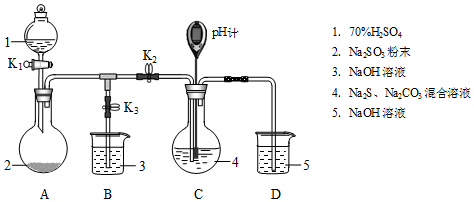
(1)装置A的作用是制备SO2,反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4.
(2)完成表实验过程:
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): S2-+H2O?HS-+OH- |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少); ⅱ.pH计读数逐渐 减小 | 反应分步进行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3 | / | 必须立即停止通SO2的原因是: SO2过量会使溶液酸度增加,使产物分解,降低产率 |
| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多空的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液. | 溶液变成棕黄色,一段时间后,溶液中有气泡出现,随后有红褐色沉淀生成. | Fe2+催化H2O2分解产生O2; H2O2分解反应放热,促进Fe3+的水解平衡正向移动. |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3 溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
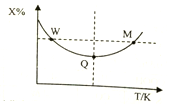 在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时,X的转化率大于Y的转化率 |
| A. | 氯水加入有色布条后,有色布条褪色,说明氯水中有 HClO 分子存在 | |
| B. | 制取漂白液的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,该反应的氧化剂与还原剂的物质的量之比为 1:1 | |
| C. | 1mol Cl2 与足量 Fe 反应,转移的电子的物质的量为 3 mol | |
| D. | 向某铁盐溶液中滴入 KSCN 溶液,无明显现象,加入氯水,溶液显血红色,说明原溶液中含有 Fe2+ |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用湿润的蓝色石蕊试纸检验某气体 | 试纸变红 | 气体呈碱性 |
| B | 铁粉中加入新制氯水,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 铁粉被氧化成Fe3+ |
| C | 向Mg(OH)2的上层清液中滴加MgCl2溶液 | 沉淀变成白色 | Qc[Mg(OH)2]<Ksp[Mg(OH)2] |
| D | 将少量溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CC14,振荡静置 | 下层分别为无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
 在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )
在同温同压下,向大小相同的气球分别充入CO和以下四种混合气体,当体积相等时A、B、C、D四个气球内,与充入CO气球内所含原子数一定相等的是( )