题目内容
20.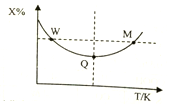 在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时,X的转化率大于Y的转化率 |
分析 A.Q点时为平衡状态;
B.由图可知,Q点后升高温度,平衡逆向移动;
C.温度越高,反应速率越大;
D.起始量之比等于化学计量数之比.
解答 解:A.Q点时为平衡状态,则Y的转化率最大,故A正确;
B.由图可知,Q点后升高温度,平衡逆向移动,则升高温度,平衡常数减小,故B错误;
C.温度越高,反应速率越大,则W点X的正反应速率小于M点X的正反应速率,故C错误;
D.起始量之比等于化学计量数之比,则平衡时,X的转化率等于Y的转化率,故D错误;
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,把握Q为平衡点及温度对平衡的影响为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
相关题目
11.下列说法与盐类水解无关的是( )
| A. | 粗盐在空气中易潮解 | B. | NH4Cl与ZnCl2用于金属焊接中除锈 | ||
| C. | 用热纯碱溶液去油污 | D. | 蒸干并灼烧FeCl3溶液得到Fe2O3 |
11.化学与生产、生活密切相关.下列有关说法不正确的是( )
| A. | 浓硫酸可作干燥剂 | B. | SO2可作食品的漂白剂 | ||
| C. | 漂白液可作环境的消毒剂 | D. | KAl(SO4)2•12H2O可作净水剂 |
8.一定量的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入( )
| A. | CH3COONa固体 | B. | Na2SO4固体 | C. | 少量NH4HSO4固体 | D. | NaOH固体 |
5.磁流体是电子材料的新秀.将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55nm的磁流体.下列说法中正确的是( )
| A. | 所得的分散系属于悬浊液 | |
| B. | 用光束照射该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中分散质为Fe2O3 | |
| D. | 分散系为胶体,胶粒直径即Fe(OH)3分子直径 |
12.下列叙述正确的是( )
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA | |
| B. | 常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA | |
| C. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L |
9.将 ag 铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加 反应的 HCl 为 0.08mol,放出标准状况下的气体 0.224L.则下列判断中正确的是( )
| A. | 此时溶液中 Fe2+和 Fe3+的物质的量之比为 3:1 | |
| B. | 向溶液中滴入 KSCN 溶液,显血红色 | |
| C. | 无法计算原混合物的质量 | |
| D. | 原混合物中 n(Fe):n(Fe2O3)=2:1 |
10.下列对实验室突发事件的处理,合理的是( )
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |