题目内容
用胆矾(化学式为CuSO4?5H2O,分子量为250)配制0.1mol/L的水溶液,下列方法正确的是( )
| A、取25 g CuSO4?5H2O溶于1 L水中 |
| B、将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1 L溶液 |
| C、将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D、将16 gCuSO4?5H2O溶于水配成1 L溶液 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:公式C=
中n指溶质的物质的量、V指溶液体积,将0.1mol溶质溶于水制成1L溶液时得到溶液的浓度为0.1mol/L,据此分析解答.
| n |
| V |
解答:
解:公式C=
中n指溶质的物质的量、V指溶液体积,25gCuSO4?5H2O的物质的量=
=0.1mol,
A.取25 g CuSO4?5H2O溶于1 L水中,溶液的体积大于1L,则配制溶液物质的量浓度小于0.1mol/L,故A错误;
B.因为配制溶液过程中还需要加入水,所以不用干燥去掉结晶水,故B错误;
C.25g CuSO4?5H2O的物质的量=
=0.1mol,将0.1mol CuSO4?5H2O溶于水制成1 L溶液可以得到0.1mol/L的硫酸铜溶液,故C正确;
D.16gCuSO4?5H2O的物质的量=
=0.064mol<0.1mol,将16 gCuSO4?5H2O溶于水配成1 L溶液其浓度小于0.1mol/L,故D错误;
故选C.
| n |
| V |
| 25g |
| 250g/mol |
A.取25 g CuSO4?5H2O溶于1 L水中,溶液的体积大于1L,则配制溶液物质的量浓度小于0.1mol/L,故A错误;
B.因为配制溶液过程中还需要加入水,所以不用干燥去掉结晶水,故B错误;
C.25g CuSO4?5H2O的物质的量=
| 25g |
| 250g/mol |
D.16gCuSO4?5H2O的物质的量=
| 16g |
| 250g/mol |
故选C.
点评:本题考查配制一定物质的量浓度溶液,明确物质的量浓度公式中各个字母的含义是解本题关键,配制溶液中还常常考查误差分析、仪器的选取等,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )| A、简单氢化物的热稳定性:C>A |
| B、最高价氧化物对应水化物的酸性:D<C |
| C、B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 |
| D、A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性 |
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种.向该溶液中加入溴水后,溴被还原,由此推断该溶液中( )
| A、不含NO3-,也不含Fe3+ |
| B、含有NO3-、I-、Cl? |
| C、含I-,且肯定含有Cl- |
| D、可能含有Fe3+ |
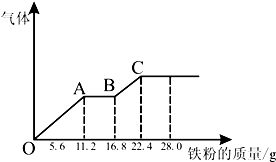 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )| A、H2SO4浓度为4mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、每份混合酸中NO3-物质的量为0.3mol |
| D、第二份溶液中最终溶质为FeSO4 |


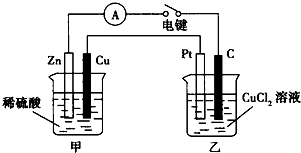 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.