题目内容
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种.向该溶液中加入溴水后,溴被还原,由此推断该溶液中( )
| A、不含NO3-,也不含Fe3+ |
| B、含有NO3-、I-、Cl? |
| C、含I-,且肯定含有Cl- |
| D、可能含有Fe3+ |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:溶液呈强酸性,向该溶液中滴入Br2,单质Br2被还原,说明溶液中含有还原性离子,为I-,则氧化性离子不能存在.
解答:
解:溶液呈强酸性,
向该溶液中滴入Br2,单质Br2被还原,说明溶液中含有还原性离子,为I-,
因NO3-、Fe3+具有强氧化性,与I-发生氧化还原反应而不能大量共存,
由于Cl-不发生反应,不能确定是否含有Cl-,
故选A.
向该溶液中滴入Br2,单质Br2被还原,说明溶液中含有还原性离子,为I-,
因NO3-、Fe3+具有强氧化性,与I-发生氧化还原反应而不能大量共存,
由于Cl-不发生反应,不能确定是否含有Cl-,
故选A.
点评:本题考查离子共存问题,题目难度中等,注意根据题目信息结合离子的性质进行判断,注意NO3-、Fe3+与I-不能大量共存.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 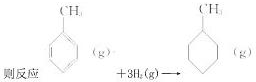 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |
现有1.0mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是( )
| A、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c( OH-) |
| B、c(Na+)=c(H2SO3)+c(HSO3-)+c( H+) |
| C、c(SO32-)+c( OH-)=c(H+)+c(H2SO3) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
用胆矾(化学式为CuSO4?5H2O,分子量为250)配制0.1mol/L的水溶液,下列方法正确的是( )
| A、取25 g CuSO4?5H2O溶于1 L水中 |
| B、将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1 L溶液 |
| C、将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D、将16 gCuSO4?5H2O溶于水配成1 L溶液 |
 通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.