题目内容
图中字母所代表的物质均为中学化学常见物质.其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质.单质E、M、N为金属,N是地壳中含量最大的金属元素.Y是红褐色沉淀.这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去.试回答下列问题:

(1)Z→L反应的名称是 .
(2)K的电子式为 .
(3)写出B→F的离子方程式 .
(4)写出K与CO2反应的化学方程式 .
(5)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式 .

(1)Z→L反应的名称是
(2)K的电子式为
(3)写出B→F的离子方程式
(4)写出K与CO2反应的化学方程式
(5)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式
考点:无机物的推断
专题:推断题
分析:常温下C、D、H为气体单质.单质E、M、N为金属,N是地壳中含量最大的金属元素,可知N为铝.Y是红褐色沉淀,Y为氢氧化铁,则Z为Fe2O3,L为Al2O3,I为Al(OH)3,C、D在光照条件下反应生成G,则应为Cl2和H2的反应,G为HCl,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,A为氯化钠,电解饱和食盐水生成H2,Cl2,和NaOH,则B为NaOH,C为H2,D为Cl2,E为电解NaCl的产物,应为Na,H为氧气,K为Na2O2;根据X与氧气反应生成氢氧化铁,则X为Fe(OH)2,J为FeCl2,B为Fe;
(1)Z→L反应是典型的铝热反应;
(2)根据反应物可推知此反应,根据书写电子式的方法书写过氧化钠的电子式,注意过氧键的问题;
(3)铝既能与强酸反应,也能与强碱反应,分别生成盐和水,根据质量守恒定律和电荷守恒书写离子方程式;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气,根据质量守恒定律书写化学方程式;
(5)根据物质的性质和氧化还原反应、离子反应的有关知识书写反应的离子方程式.
(1)Z→L反应是典型的铝热反应;
(2)根据反应物可推知此反应,根据书写电子式的方法书写过氧化钠的电子式,注意过氧键的问题;
(3)铝既能与强酸反应,也能与强碱反应,分别生成盐和水,根据质量守恒定律和电荷守恒书写离子方程式;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气,根据质量守恒定律书写化学方程式;
(5)根据物质的性质和氧化还原反应、离子反应的有关知识书写反应的离子方程式.
解答:
解:常温下C、D、H为气体单质.单质E、M、N为金属,N是地壳中含量最大的金属元素,可知N为铝.Y是红褐色沉淀,Y为氢氧化铁,则Z为Fe2O3,L为Al2O3,I为Al(OH)3,C、D在光照条件下反应生成G,则应为Cl2和H2的反应,G为HCl,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,A为氯化钠,电解饱和食盐水生成H2,Cl2,和NaOH,则B为NaOH,C为H2,D为Cl2,E为电解NaCl的产物,应为Na,H为氧气,K为Na2O2;根据X与氧气反应生成氢氧化铁,则X为Fe(OH)2,J为FeCl2,B为Fe;
(1)Z→L反应为2Al+Fe2O3
2Fe+Al2O3,为重要的铝热反应,故答案为:铝热反应;
(2)过氧化钠为离子化合物,化合物中含有过氧键,电子式为: ,故答案为:
,故答案为: ;
;
(3)铝既能与强酸反应,也能与强碱反应,分别生成盐和水,与氢氧化钠溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(5)NaClO在碱性条件下具有强氧化,可进一步氧化2Fe(OH)3,反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
(1)Z→L反应为2Al+Fe2O3
| ||
(2)过氧化钠为离子化合物,化合物中含有过氧键,电子式为:
 ,故答案为:
,故答案为: ;
;(3)铝既能与强酸反应,也能与强碱反应,分别生成盐和水,与氢氧化钠溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(5)NaClO在碱性条件下具有强氧化,可进一步氧化2Fe(OH)3,反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
点评:本题考查无机物的推断,为高考常见题型,重点考查,电解食盐水的基本原理,并能写出相应的电极反应式和总反应的化学方程式,注意能列举实例说明氯碱工业产品的主要用途,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
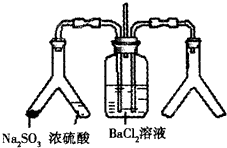 将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )| A、石灰石和稀硝酸 |
| B、CaO和氯化铵 |
| C、Cu和浓硝酸 |
| D、Na2O2和食盐水 |
用胆矾(化学式为CuSO4?5H2O,分子量为250)配制0.1mol/L的水溶液,下列方法正确的是( )
| A、取25 g CuSO4?5H2O溶于1 L水中 |
| B、将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1 L溶液 |
| C、将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D、将16 gCuSO4?5H2O溶于水配成1 L溶液 |
在相同条件下,燃烧时对大气污染程度最小的燃料是( )
| A、液化气 | B、煤油 | C、煤球 | D、木柴 |
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO3-、CO32-、OH-.已知甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是( )
| A、Cu2+、H+、NO3- |
| B、K+、CO32-、OH- |
| C、CO32-、OH-、NO3- |
| D、K+、H+、NO3- |
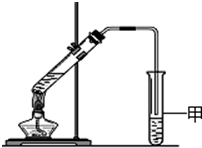 通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.