题目内容
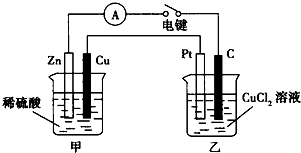 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
(1)甲装置的名称是
(2)写出电极反应:Cu极
(3)当甲中产生0.1mol气体时,乙中析出铜的质量应为
(4)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色
(5)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将
(6)如果乙中电极不变,将其溶液换成饱和Na2SO4溶液,电键闭合一段时间,当阴极上有a mol气体生成时,同时有w g Na2S04?1OH20析出,若温度不变,剩余溶液中溶质的质量分数应为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据构成原电池的条件知:甲装置为铜锌原电池,Zn为负极,Cu为正极;乙装置为电解池,与正极相连的为阳极;
(2)Cu极上氢离子得电子;C极上铜离子得电子;
(3)根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,转移0.2mol电子,根据电子守恒计算乙中产生的固体和气体;
(4)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,根据电镀原理分析;
(5)甲中反应消耗氢离子,乙中电解NaCl溶液生成氢氧化钠;
(6)电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液,根据质量分数公式计算即可.
(2)Cu极上氢离子得电子;C极上铜离子得电子;
(3)根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,转移0.2mol电子,根据电子守恒计算乙中产生的固体和气体;
(4)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,根据电镀原理分析;
(5)甲中反应消耗氢离子,乙中电解NaCl溶液生成氢氧化钠;
(6)电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液,根据质量分数公式计算即可.
解答:
解:(1)由图中的铜、锌两种电极和电解质稀硫酸和闭合电路知:该装置为原电池,Zn活泼,则Zn作负极,Cu作正极,则乙装置为电解池,C极与负极相连为阴极,Pt极与正极相连为阳极;
故答案为:原电池;电解池;负;阳;
(2)甲装置为原电池,Cu极为正极,正极上氢离子得电子,正极上的反应为:2H++2e-=H2↑,乙装置为电解池,C极与负极相连为阴极,阴极上铜离子得电子,则电极反应为Cu2++2e-=Cu;
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(3)根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,甲中2H++2e-=H2↑,则转移0.2mol电子,连接电源负极的碳电极为电解池的阴极,转移0.2mol电子,根据Cu2++2e-=Cu,乙中析出铜的物质的量为0.1mol,质量为6.4克,电解池的阳极上发生氧化反应:2Cl--2e-=Cl2↑,则生成气体为0.1mol,其体积为2.24L
故答案为:6.4g;2.24L;
(4)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,阳极铜失电子生成铜离子,阴极铜离子得电子生成铜单质,则溶液中铜离子的浓度不变,所以溶液的颜色不变;
故答案为:无变化;
(5)甲中发生的反应为Zn与氢离子的反应,反应消耗氢离子,则pH增大,乙中电极不变,将其溶液换成NaCl溶液,则乙中电解NaCl溶液生成氢氧化钠,所以溶液的pH增大;
故答案为:增大;增大;
(6)电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液.
w g Na2SO4?10H2O硫酸钠的质量=w g×
=
g;
设电解水的质量为x:
2H2O
2H2↑+O2↑
36g mol
x amol
x=36ag
所以饱和溶液的质量分数:
×100%=
×100%;
故答案为:
×100%.
故答案为:原电池;电解池;负;阳;
(2)甲装置为原电池,Cu极为正极,正极上氢离子得电子,正极上的反应为:2H++2e-=H2↑,乙装置为电解池,C极与负极相连为阴极,阴极上铜离子得电子,则电极反应为Cu2++2e-=Cu;
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(3)根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,甲中2H++2e-=H2↑,则转移0.2mol电子,连接电源负极的碳电极为电解池的阴极,转移0.2mol电子,根据Cu2++2e-=Cu,乙中析出铜的物质的量为0.1mol,质量为6.4克,电解池的阳极上发生氧化反应:2Cl--2e-=Cl2↑,则生成气体为0.1mol,其体积为2.24L
故答案为:6.4g;2.24L;
(4)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,阳极铜失电子生成铜离子,阴极铜离子得电子生成铜单质,则溶液中铜离子的浓度不变,所以溶液的颜色不变;
故答案为:无变化;
(5)甲中发生的反应为Zn与氢离子的反应,反应消耗氢离子,则pH增大,乙中电极不变,将其溶液换成NaCl溶液,则乙中电解NaCl溶液生成氢氧化钠,所以溶液的pH增大;
故答案为:增大;增大;
(6)电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液.
w g Na2SO4?10H2O硫酸钠的质量=w g×
| 142 |
| 322 |
| 142w |
| 322 |
设电解水的质量为x:
2H2O
| ||
36g mol
x amol
x=36ag
所以饱和溶液的质量分数:
| ||
| w+36a |
| 142w |
| 322(w+36a) |
故答案为:
| 142w |
| 322(w+36a) |
点评:本题考查了原电池和电解池原理,正确判断原电池和电解池是解本题关键,根据离子的放电顺序、串联电路中转移电子相等来分析解答,难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
用胆矾(化学式为CuSO4?5H2O,分子量为250)配制0.1mol/L的水溶液,下列方法正确的是( )
| A、取25 g CuSO4?5H2O溶于1 L水中 |
| B、将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1 L溶液 |
| C、将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D、将16 gCuSO4?5H2O溶于水配成1 L溶液 |
在相同条件下,燃烧时对大气污染程度最小的燃料是( )
| A、液化气 | B、煤油 | C、煤球 | D、木柴 |
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO3-、CO32-、OH-.已知甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是( )
| A、Cu2+、H+、NO3- |
| B、K+、CO32-、OH- |
| C、CO32-、OH-、NO3- |
| D、K+、H+、NO3- |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有: