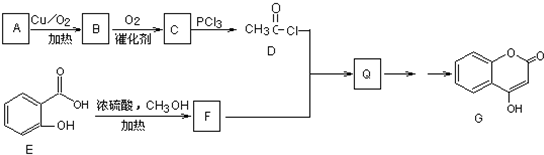
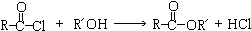题目内容
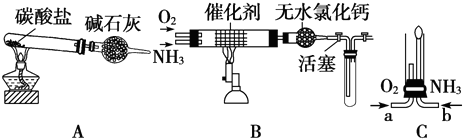
某同学用下列装置(固定、加热仪器和橡胶管已经省略)进行有关气体制取及其相关实验的探究,回答下列问题.
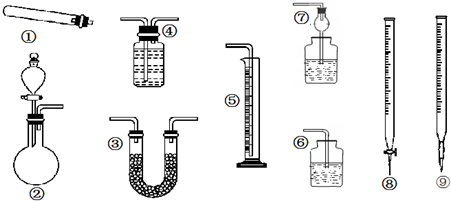
(1)若用装置①制取NH3,其反应的化学方程式为 ;多余的氨气应选用 装置吸收.(填装置序号,下同)
(2)若用装置②制乙炔,其反应的化学方程式为 ;要测定生成乙炔的体积,则必须选择的装置是 ,因制取的乙炔常含有杂质,若要除去杂质,所选装置中应盛放的试剂为: .
(3)若用装置②制取乙烯,少了一种重要仪器 .
(4)若用0.01mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸溶液,酸性高锰酸钾溶液应装在 装置中.

(1)若用装置①制取NH3,其反应的化学方程式为
(2)若用装置②制乙炔,其反应的化学方程式为
(3)若用装置②制取乙烯,少了一种重要仪器
(4)若用0.01mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸溶液,酸性高锰酸钾溶液应装在
考点:制备实验方案的设计,常见气体制备原理及装置选择,实验装置综合
专题:实验题
分析:(1)若用装置①制取NH3,则实验室用氯化铵和氢氧化钙在加热条件下制取氨气;氨气应尾气处理,要防止倒吸;
(2)用装置②制乙炔,选碳化钙与水反应,要测定乙炔的体积,可以采用排液体的方法测量,且乙炔和该液体不能反应、乙炔不能溶于该液体、该液体不能挥发,乙炔中混有硫化氢杂质;
(3)制备乙烯需要乙醇在170℃发生消去反应制备;
(4)酸性高锰酸钾具有强氧化性,能氧化腐蚀橡胶.
(2)用装置②制乙炔,选碳化钙与水反应,要测定乙炔的体积,可以采用排液体的方法测量,且乙炔和该液体不能反应、乙炔不能溶于该液体、该液体不能挥发,乙炔中混有硫化氢杂质;
(3)制备乙烯需要乙醇在170℃发生消去反应制备;
(4)酸性高锰酸钾具有强氧化性,能氧化腐蚀橡胶.
解答:
解:(1)若用装置①制取NH3,则实验室用氯化铵和氢氧化钙在加热条件下制取氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
⑥、⑦均可吸收尾气,但⑥可导致倒吸,只有⑦符合,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;⑦;
(2)装置②制乙炔,其反应的化学方程式为CaC2+2H2O→C2H2↑+Ca(OH)2,要测定生成乙炔的体积,利用排水法测定水的体积即为乙炔的体积,则则必须选择的装置是④⑤,混有的杂质可利用CuSO4溶液除去,而乙炔不反应,
故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;④⑤;CuSO4溶液;
(3)制备乙烯需要乙醇在170℃发生消去反应制备,则图中缺少温度计测定反应液的温度,故答案为:温度计;
(4)酸性高锰酸钾具有强氧化性,能氧化腐蚀橡胶,则应装在⑧酸式滴定管中,故答案为:⑧.
| ||
⑥、⑦均可吸收尾气,但⑥可导致倒吸,只有⑦符合,
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)装置②制乙炔,其反应的化学方程式为CaC2+2H2O→C2H2↑+Ca(OH)2,要测定生成乙炔的体积,利用排水法测定水的体积即为乙炔的体积,则则必须选择的装置是④⑤,混有的杂质可利用CuSO4溶液除去,而乙炔不反应,
故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;④⑤;CuSO4溶液;
(3)制备乙烯需要乙醇在170℃发生消去反应制备,则图中缺少温度计测定反应液的温度,故答案为:温度计;
(4)酸性高锰酸钾具有强氧化性,能氧化腐蚀橡胶,则应装在⑧酸式滴定管中,故答案为:⑧.
点评:本题考查制备实验方案的设计,为高频考点,把握氨气、乙炔、乙烯的制备原理及实验装置为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.

练习册系列答案
相关题目
下列有关水的说法错误的是( )
| A、水是氧化物 |
| B、煮沸可降低自来水的硬度 |
| C、肥皂水可区分硬水和软水 |
| D、电解水的实验,说明水是由氢气和氧气组成的 |
下列说法正确的是( )
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 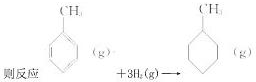 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |
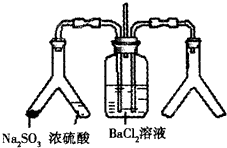 将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )| A、石灰石和稀硝酸 |
| B、CaO和氯化铵 |
| C、Cu和浓硝酸 |
| D、Na2O2和食盐水 |
用胆矾(化学式为CuSO4?5H2O,分子量为250)配制0.1mol/L的水溶液,下列方法正确的是( )
| A、取25 g CuSO4?5H2O溶于1 L水中 |
| B、将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1 L溶液 |
| C、将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D、将16 gCuSO4?5H2O溶于水配成1 L溶液 |
 如图是某研究性小组设计的一个储气装置图.
如图是某研究性小组设计的一个储气装置图.