题目内容
20.下列图象与对应叙述相符合的是( )| A. | 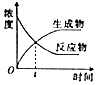 图表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态 | |
| B. | 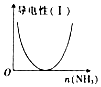 图表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. |  图表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂 | |
| D. | 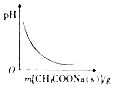 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 |
分析 A、t时反应物和生成物的浓度相等,而不是不变;
B、向CH3COOH溶液中通入NH3生成醋酸铵,自由移动离子浓度变大,导电性开始应增强;
C、使用催化剂,降低反应所需的活化能;
D、CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液的pH增加.
解答 解:A、t时反应物和生成物的浓度相等,而不是不变,所以t时不是平衡状态,故A错误;
B、向CH3COOH溶液中通入NH3生成醋酸铵,体积不变,自由移动离子浓度变大,导电性开始应增强,而不是减弱,故B错误;
C、使用催化剂,降低反应所需的活化能,则b表示在反应体系中加入了催化剂,故C正确;
D、CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液的pH增加,而不是减小,故D错误;
故选:C.
点评 本题考查较综合,涉及平衡图象、反应活化能、pH及导电性等,注重高频考点的考查,把握图中纵横坐标的含义及点、线、面的含义是解答本题的关键,注意相关化学反应原理的应用,题目难度不大.

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
12. 在杠杆的两端分别挂着质量和体积都相同的空心铝球和铜球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铁溶液中片刻,如图,则下列说法正确的是( )
在杠杆的两端分别挂着质量和体积都相同的空心铝球和铜球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铁溶液中片刻,如图,则下列说法正确的是( )
 在杠杆的两端分别挂着质量和体积都相同的空心铝球和铜球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铁溶液中片刻,如图,则下列说法正确的是( )
在杠杆的两端分别挂着质量和体积都相同的空心铝球和铜球,此时杠杆平衡.然后将两球分别浸没在氢氧化钠溶液和硫酸铁溶液中片刻,如图,则下列说法正确的是( )| A. | 两烧杯中均无气泡产生 | B. | 左边烧杯中的溶液质量增加了 | ||
| C. | 在浸没过程中,杠杆始终保持平衡 | D. | 右边铜球质量不变 |
13.下列离子方程式正确的是( )
| A. | 加热TiCl4浓溶液制备TiO2•xH2O2:Ti4++(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4H+ | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量KOH溶液:NH4++OH-═NH3↑+H2O | |
| C. | 钢铁发生吸氧腐蚀时的正极反应:O2+4H++4e-═2H2O | |
| D. | 酸性KI溶液中通入O2:4H++2I-+O2═2H2O+I2 |
10.下列叙述不正确的是( )
| A. | 常温下,在$\frac{c(H+)}{c(OH-)}$=1012的溶液中,Fe2+、I-、NO3-、Cl-一定不能大量共存 | |
| B. | H2A是二元弱酸,常温下,0.1mol/LNaHA溶液的pH约为5,说明HA-电离程度大于水解程度 | |
| C. | 使用催化剂一定能够降低化学反应的反应热(△H) | |
| D. | NA为阿伏加德罗常数的值,常温常压下,28gC2H4和C3H6混合气体含有的原子数为6NA |
15.下列有关化学用语表示正确的是( )
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 硫离子的结构示意图: | ||
| C. | NH4Cl的电子式: | D. | 苯甲酸乙酯的结构简式: |
11. 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物有结构如图所示.下列说法正确的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物有结构如图所示.下列说法正确的是( )
 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物有结构如图所示.下列说法正确的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物有结构如图所示.下列说法正确的是( )| A. | 分子式为C14H18O4 | |
| B. | 环上氢原子的一氯取代物3种 | |
| C. | 1mol该有机物与足量的NaOH溶液反应最多消耗4molNaOH | |
| D. | 能发生酯化反应 |
8.下列说法正确的是( )
| A. | 石油裂解为乙烯属于取代反应 | |
| B. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| C. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| D. | C4H10进行一氯取代后生成四种沸点不同的产物 |
9.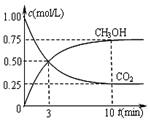 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)<c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).