题目内容
9. 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.(1)已知①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
则碳与水蒸气反应C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3.
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①工业生产过程中CO2和H2的转化率后者大(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是降低温度、增大压强(填两点).
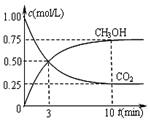
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图所示.该温度下的平衡常数为5.33(保留三位有效数字).
(3)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率υ(CH3OH)=0.025mol•L-1•min-1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
分析 (1)①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
结合盖斯定律计算,①-②-2×③得到碳与水蒸气反应的热化学方程式;
(2)①可逆反应中增大一种反应物浓度可以提高另一种反应物转化率;
依据CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0为气体体积减小的、放热反应特点结合影响化学平衡移动的因素解答;
②计算平衡时氢气、水的浓度,再根据K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$计算平衡常数;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
②反应速率V=$\frac{△c}{△t}$计算得到氢气反应速率,速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量得到平衡浓度,计算此时平衡常数,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),计算此时浓度商和平衡常数比较判断反应进行方向.
解答 解:(1)①C(s)+O2(g)=CO2(g)△H1
②2H2(g)+O2(g)=2H2O (l)△H2
③H2O (l)=H2O (g)△H3
结合盖斯定律计算,①-②-2×③得到碳与水蒸气反应的热化学方程式为:C(s)+2H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2(g)+2H2(g)的△H=△H1-△H2-2△H3,
故答案为:△H1-△H2-2△H3;
(2)①C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0生成二氧化碳和氢气的物质的量之比为1:2,而CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,二氧化碳和氢气物质的量之比为1:3,相对与增大二氧化碳浓度,所以氢气的转化率大于二氧化碳转化率;
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0为气体体积减小的、放热反应,要想提高甲醇的产率可以采取的措施是降低温度、增大压强使平衡向正向移动;
故答案为:后者大;降低温度、增大压强;
②平衡时甲醇为0.75mol/L、二氧化碳为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.50 0.75 0.75 0.75
则平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{2}}$=$\frac{16}{3}$=5.33,
故答案为:5.33;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ是恒温恒容容器,Ⅱ为恒容绝热,反应是放热反应,图表中反应ⅠⅡ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,甲醇浓度增大;
故答案为:<;<;
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.5 1.5 0.5 0.5
30min量(mol/L) 0.5 1.5 0.5 0.5
对反应I,前10min内的平均反应速率v(CH3OH)=$\frac{1}{3}$V(H2)=$\frac{1}{3}$×(6-4.5)mol2L10min=0.025mol•L-1•min-1;
平衡常数K=$\frac{0.5×0.5}{0.5×1.{5}^{3}}$=$\frac{0.5}{1.{5}^{3}}$,
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
3 0min量(mol/L) 0.5 1.5 0.5 0.5
(mol/L) 1 1.5 0.5 1
浓度商Q=$\frac{1×0.5}{1×1.{5}^{3}}$=$\frac{0.5}{1.{5}^{3}}$=K,
所以平衡不移动;
故答案为:0.025mol•L-1•min-1 ;不.
点评 本题为综合题,涉及反应热的计算、化学平衡平衡移动影响因素、化学平衡常数计算,题目难度中等,解题关键需掌握化学平衡理论,注意三段式的应用.

| A. | 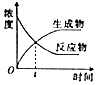 图表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态 | |
| B. | 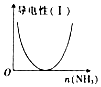 图表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. |  图表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂 | |
| D. | 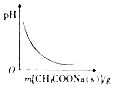 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 |
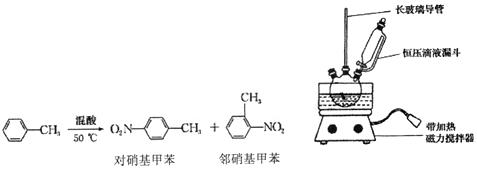
| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
①配制混酸,组装如图反应装置.取100mL 烧杯,用10mL 浓硫酸与30mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15mL 甲苯(折合质量13.0g)加入三颈烧瓶中.
②向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀.
③在50一60℃下发生反应,直至反应结束.
④除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
请回答下列问题:
(l)配制40mL 混酸的操作是分别取30mL浓硝酸和10mL浓硫酸,将30mL浓硝酸倒入烧杯中,再慢慢沿烧杯内壁注入10mL浓硫酸,边加边搅拌.
(2)装置中还缺少温度计 (填仪器名称).如果温度超过60℃,将会有二硝基甲苯或三硝基甲苯(填物质名称)生成.
(3)分离粗产品和水的操作方法是分液.
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是取最后一次洗涤液少许于试管中,滴加氯化钙溶液,无沉淀生成,则说明已洗净.
(5)为了得到更纯净的硝基苯,还须先向液体中加入CaO 除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是70.8%.
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 高纯度的SiO2可以制成光电池将光能直接转化为电能 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
(1)该同学选用如图所示的部分装置(可以重复选用)进行实验,装置依次连接的合理顺序为A、B、D、C、E、D、F.
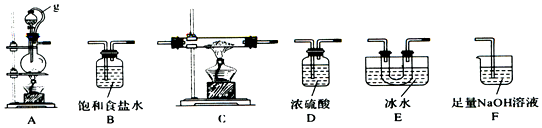
(2)A中反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E 的作用是冷凝并收集BC13.
(4)停止实验,正确的操作是先熄灭C处酒精灯,再拔F处导管,后熄灭A处酒精灯.
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4〕,则硼酸在水中的电离方程式是H3BO3+H2O═[B(OH)4]-+H+.
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LN a0H)滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案.
| 实验序号 | 0.1mol/L NaClO溶液/mL | 0.1mol/L NaCl溶液/mL | 0.2mol/L NaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | 4.0 | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的粒子是Cl2;乙同学认为这是发生化学反应所致,使溶液变黄色的粒子是Fe3+;(以上2空填相应微粒的符号)
(2)现提供以下试剂:
A.酸性高锰酸钾溶液
B.氢氧化钠溶液
C.四氯化碳
D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象.
| 乙同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
| A. |  2种 | B. |  2种 | C. |  3 种 | D. |  2种 |
| A. | 硫酸 | B. | 碘水 | C. | 硝酸锌 | D. | 氯化铜 |
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下: