题目内容
某有机物完全燃烧,生成的产物只有CO2和H2O.将6g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重7.2g,再通过氢氧化钠溶液,又增重13.2g.该有机物的分子式为( )
| A、C4H10 |
| B、C3H8 |
| C、C3H8O |
| D、C2H4O2 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:根据浓硫酸和氢氧化钠溶液增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式.
解答:
解:浓硫酸增重可知水的质量为7.2g,可计算出n(H2O)=
=0.4mol,n(H)=0.8mol,m(H)=0.8g;氢氧化钠溶液增重13.2g,可知二氧化碳质量为13.2g,n(C)=n(CO2)=
=0.3mol,m(C)=3.6g,m(C)+m(H)=4.4g,有机物的质量为6g,所以有机物中氧的质量为1.6g,n(O)=
=0.1mol,
n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O;
故选:C.
| 7.2g |
| 18g/mol |
| 13.2g |
| 44g/mol |
| 1.6g |
| 16g/mol |
n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O;
故选:C.
点评:此题考查了分子式的计算,计算时含氧可根据质量守恒来确定和计算,需要注意的是若实验式中碳原子已经饱和,则分子式和实验式是一样的.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
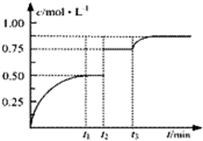 一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A、t1~t3间该反应的平衡常数均为4 |
| B、反应方程式中的x=1 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量物质D |
下列检验离子的方法及现象描述正确的是( )
| A、检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 |
| B、检验Cl-:加入AgNO3溶液出现白色沉淀 |
| C、检验Na+:将干净的铂丝蘸取少量溶液灼烧,观察火焰呈黄色 |
| D、检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
实验室用固态不纯氯化钠(含少量Na2SO4杂质)制取纯净氯化钠固体.下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②加热溶液蒸干;
③加蒸馏水溶解;
④加入稍过量的Na2CO3溶液;
⑤加入稍过量的BaCl2溶液;
⑥过滤.
上述实验操作的正确顺序应是( )
①逐滴加入稀盐酸,调节pH值为5;
②加热溶液蒸干;
③加蒸馏水溶解;
④加入稍过量的Na2CO3溶液;
⑤加入稍过量的BaCl2溶液;
⑥过滤.
上述实验操作的正确顺序应是( )
| A、①②⑤⑥③④ |
| B、③⑤④⑥①② |
| C、④③⑥⑤①② |
| D、④③⑤⑥②① |
为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,①加水溶解②加热蒸发得到晶体③加入过量BaCl2溶液④加入过量盐酸⑤加入过量K2CO3⑥过滤.正确的次序是( )
| A、①⑤③⑥④② |
| B、①⑤③④⑥② |
| C、①③④⑥⑤② |
| D、①③⑤⑥④② |
下列关于实验原理或操作的叙述中,正确的是( )
| A、NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出即停止加热 |
| B、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C、在50mL量筒中配制0.10mol/L的碳酸钠溶液 |
| D、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |