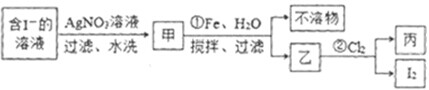
题目内容
实验室用固态不纯氯化钠(含少量Na2SO4杂质)制取纯净氯化钠固体.下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②加热溶液蒸干;
③加蒸馏水溶解;
④加入稍过量的Na2CO3溶液;
⑤加入稍过量的BaCl2溶液;
⑥过滤.
上述实验操作的正确顺序应是( )
①逐滴加入稀盐酸,调节pH值为5;
②加热溶液蒸干;
③加蒸馏水溶解;
④加入稍过量的Na2CO3溶液;
⑤加入稍过量的BaCl2溶液;
⑥过滤.
上述实验操作的正确顺序应是( )
| A、①②⑤⑥③④ |
| B、③⑤④⑥①② |
| C、④③⑥⑤①② |
| D、④③⑤⑥②① |
考点:粗盐提纯
专题:实验设计题
分析:将固体加水溶解,加入足量的BaCl2溶液除去Na2SO4杂质,然后再加入过量的Na2CO3溶液除去BaCl2,最后加入盐酸,加热可制取纯净氯化钠溶液.
解答:
解:将固体加水溶解,向溶液中加入足量的BaCl2溶液,目的是除去硫酸钠;向试管溶液中再加入足量Na2CO3溶液,目的是除去多余的氯化钡;
过滤是除去硫酸钡和碳酸钡沉淀;
向滤液中加入盐酸至不再产生气泡为止,目的是除去多余的碳酸钠;
将溶液加热煮沸即得到NaCl溶液,目的是除去多余的盐酸.
所以实验步骤:③加蒸馏水溶解;⑤加入稍过量的BaCl2溶液;④加入稍过量的Na2CO3溶液;⑥过滤;①逐滴加入稀盐酸,调pH值为5;②煮沸.
故选B.
过滤是除去硫酸钡和碳酸钡沉淀;
向滤液中加入盐酸至不再产生气泡为止,目的是除去多余的碳酸钠;
将溶液加热煮沸即得到NaCl溶液,目的是除去多余的盐酸.
所以实验步骤:③加蒸馏水溶解;⑤加入稍过量的BaCl2溶液;④加入稍过量的Na2CO3溶液;⑥过滤;①逐滴加入稀盐酸,调pH值为5;②煮沸.
故选B.
点评:本题主要考查实验方案的设计,解题的关键是掌握各物质的性质以及操作步骤,难度较大.本题为综合型的实验题,做题时要认真审题,要细心,步步为营.

练习册系列答案
相关题目
 将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)?2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )
将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)?2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )| A、T0对应的V(正)和V(逆)的关系是:V(正)=V(逆) |
| B、此反应的正反应为放热反应 |
| C、A、B两点正反应速率的大小关系是:V(A)=V(B) |
| D、若B点的W的物质的量分数为50.0%,则参加反应的X的物质的量为1.6mol |
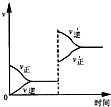 若平衡体系A+B═C+D,增大压强时反应速率变化如图所示.则下列关于各物质状态的说法正确的是( )
若平衡体系A+B═C+D,增大压强时反应速率变化如图所示.则下列关于各物质状态的说法正确的是( )| A、A、B、C、D都是气体 |
| B、C、D都是气体,A、B中有一种是气体 |
| C、A、B都不是气体,C、D中有一种是气体 |
| D、A、B都是气体,C、D中有一种是气体 |
有机物结构式可以简化,如: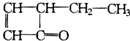 可表示为
可表示为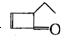 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
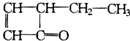 可表示为
可表示为 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A、6种 | B、5种 | C、4种 | D、3种 |
某有机物完全燃烧,生成的产物只有CO2和H2O.将6g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重7.2g,再通过氢氧化钠溶液,又增重13.2g.该有机物的分子式为( )
| A、C4H10 |
| B、C3H8 |
| C、C3H8O |
| D、C2H4O2 |
有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲 乙
乙
甲:a(g)+b(g)?2c(g)△H1<0 乙:x(g)+3y(g)?2z(g)△H2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
甲
 乙
乙甲:a(g)+b(g)?2c(g)△H1<0 乙:x(g)+3y(g)?2z(g)△H2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
| A、绝热下向甲中通入惰性气体,c的物质的量不变 |
| B、绝热下向乙中通入z气体,反应器中温度升高 |
| C、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大 |
| D、恒温下向乙中通入z气体,y的物质的量浓度增大 |
将自来水加工成蒸馏水过程中,没有涉及到的过程或变化是( )
| A、化学变化 | B、冷凝 |
| C、蒸发 | D、物理变化 |