题目内容
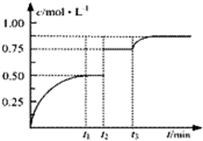 一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A、t1~t3间该反应的平衡常数均为4 |
| B、反应方程式中的x=1 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量物质D |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:根据图可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,且该反应前后气体体积不变,所以可知x=2,再根据平衡常数的定义计算平衡常数,在可逆反应中固体物质的量的少量改变不会引起平衡的移动,据此答题;
解答:
解:A、根据图可知,在t2时刻,平衡不移动,但C的浓度变大,说明在在t2时刻改变的条件是缩小容器的体积,且该反应前后气体体积不变,所以可知x=2,所以化学方程式为:A(g)+B(g)?2C(g)+D(s),根据方程式中的计量关系可知,在t1时刻达到平衡,生成0.5mol/LC,则A、B平衡的浓度均为0.25mol/L,所以平衡常数K=
=4,而t1~t3间温度没变,所以平衡常数不变,故A正确;
B、由A中的分析可知x=2,故B错误;
C、催化剂不能改变平衡时的浓度,结合A的分析可知C错误;
D、由于D为固体,移去少量物质D,平衡不移动,不会改变其它物质的浓度,故D错误;
故选A.
| 0.52 |
| 0.25×0.25 |
B、由A中的分析可知x=2,故B错误;
C、催化剂不能改变平衡时的浓度,结合A的分析可知C错误;
D、由于D为固体,移去少量物质D,平衡不移动,不会改变其它物质的浓度,故D错误;
故选A.
点评:本题主要考查了根据图象判断影响平衡移动的因素,中等难度,解题的关键在于根据图象确定化学方程式中的x的值.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
已知某有机物的分子式为C3HmOn(m、n均是不为0的正整数),下列关于C3HmOn的说法中正确的是( )
| A、当m=8时,该物质可以发生加成反应 |
| B、无论n为多少,m不可能为奇数 |
| C、当m=6、n=2时,该物质不可能含有两种官能团 |
| D、1个C3HmOn可能含有3个醛基 |
向一定量Fe、Fe2O3的混合物中加入250mL 2mol?L-1的HNO3溶液,反应完成后生成1.12L(标准状况下)NO气体,再向反应后溶液中加入1mol?L-1 NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液体积最少是( )
| A、450 mL |
| B、500 mL |
| C、400 mL |
| D、不能确定 |
在105℃时,取两种气态烃1L与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.有下列组合的混合烃:①C2H4和C3H4 ②CH4和C2H6 ③CH4和C4H4 ④C2H2和C3H6其中可能符合上述要求的是( )
| A、只有①② | B、只有①③ |
| C、只有①③④ | D、只有②④ |
将镁、铝、硅的混合物分为等质量的两份.一份与足量NaOH溶液反应,另一份与足量盐酸反应,最后生成的氢气一样多.则镁与硅物质的量之比为( )
| A、2:1 | B、4:1 |
| C、1:1 | D、3:1 |
 将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)?2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )
将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)?2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )| A、T0对应的V(正)和V(逆)的关系是:V(正)=V(逆) |
| B、此反应的正反应为放热反应 |
| C、A、B两点正反应速率的大小关系是:V(A)=V(B) |
| D、若B点的W的物质的量分数为50.0%,则参加反应的X的物质的量为1.6mol |
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列研究结果和示意图相符的是( )
| A | B | C | D | |
| 研究 结果 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |  |  |
| A、A | B、B | C、C | D、D |
某有机物完全燃烧,生成的产物只有CO2和H2O.将6g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重7.2g,再通过氢氧化钠溶液,又增重13.2g.该有机物的分子式为( )
| A、C4H10 |
| B、C3H8 |
| C、C3H8O |
| D、C2H4O2 |