题目内容
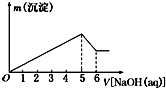 向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )
向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
考点:有关混合物反应的计算
专题:
分析:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为1mL,根据离子方程式Al3++3OH-═Al(OH)3↓,可知沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液5L,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,据此确定溶液中n(Mg2+):n(Al3+),据此计算解答.
解答:
解:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为1mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为1mL×3=3mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液5mL,则沉淀Mg2+消耗的氢氧化钠溶液的体积为5mL-3mL=2mL,则n(Mg2+):n(Al3+)=
×2mL:
×3mL=1:1,故原来混合溶液中MgSO4与Al2(SO4)3和的物质的量之比为1:
=2:1,故选D.
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |
点评:本题考查镁铝化合物性质、混合物的有关计算,难度中等,根据清楚图象反应过程是解题关键.

练习册系列答案
相关题目
检验某未知溶液中是否含有SO42-,下列操作最合理的是( )
| A、加入盐酸酸化,将可能出现的沉淀过滤后,再加入Ba(NO3)2溶液 |
| B、先加入HNO3溶液酸化,再加入Ba(NO3)2溶液 |
| C、加入盐酸酸化的Ba Cl2溶液 |
| D、加入盐酸酸化,将可能出现的沉淀过滤后,再加入Ba Cl2溶液 |
对于某些离子的检验及结论一定正确的是( )
| A、加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入AgNO3溶液,生成白色沉淀,加稀硝酸沉淀不溶解,说明含有Cl- |
| C、加入氯化钡有白色沉淀,再加盐酸,沉淀不消失,一定有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
下列物质中不含蛋白质的是( )
| A、羊毛衫 | B、牛奶 | C、酶 | D、棉花 |
下列实验事实不能证明醋酸是弱酸的是( )
| A、常温下,含有石蕊的醋酸溶液加热颜色变深 |
| B、常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C、常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D、常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是( )
| A、NaOH溶液 | B、硝酸银溶液 |
| C、盐酸 | D、氨水 |
常温下用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=6.则此溶液的实际pH( )
| A、大于6 | B、小于6 |
| C、等于6 | D、大于7 |