题目内容
下列实验事实不能证明醋酸是弱酸的是( )
| A、常温下,含有石蕊的醋酸溶液加热颜色变深 |
| B、常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C、常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D、常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度解答.
解答:
解:A.弱酸的电离吸热,升温时,含有石蕊的醋酸溶液加热颜色变深,说明促进了醋酸的电离,证明溶液中存在醋酸分子,醋酸是弱酸,故A正确;
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,说明醋酸没有完全电离,可证明醋酸为弱酸,故B正确;
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进电离,如为强酸,稀释后pH=4,可证明为弱酸,故C正确;
D.醋酸为一元酸,氢氧化钠为一元碱,二者恰好反应,不能证明醋酸为弱酸,故D错误;
故选D.
B.常温下,测得0.1 mol/L醋酸溶液的pH=4,说明醋酸没有完全电离,可证明醋酸为弱酸,故B正确;
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进电离,如为强酸,稀释后pH=4,可证明为弱酸,故C正确;
D.醋酸为一元酸,氢氧化钠为一元碱,二者恰好反应,不能证明醋酸为弱酸,故D错误;
故选D.
点评:本题考查实验方案的评价,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
用简便的方法鉴别硫酸铜、碳酸钠、氢氧化镁三种白色固体粉末,应选用的最佳试剂是( )
| A、稀盐酸 | B、紫色石蕊试液 |
| C、水 | D、氢氧化钠溶液 |
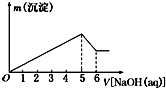 向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )
向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
已知;HCN的K=4.9×10-10,H2CO3的K1=4.3×10-7,K2=5.6×10-11.判断等浓度的NaCN、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A、c(CN-)>c(HCO3-)>c(OH-)>c(H+) |
| B、c (CO32-)>c(CN-)>c(OH-)>c(H+) |
| C、c(CN-)+c(HCN)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| D、c(Na+)+c(H+)=c(CN-)+c(HCO3-)+c(OH-)+c(CO32-) |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)=2Z(g)+W(s)△H<0,下列叙述正确的是( )
| A、达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B、达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C、达到平衡时,反应速率v正(X)=2v逆(Z) |
| D、平衡常数K值越大,X的转化率越大 |
下列各组中两种溶液间的反应,能用同一离子方程式来表示的是( )
| A、HCl+Na2CO3;H2SO4+KHCO3 |
| B、BaCl2+Na2SO4;Ba(OH)2+(NH4)2SO4 |
| C、Fe+H2SO4(稀);Fe+CH3COOH(稀) |
| D、NaHCO3(过量)+Ca(OH)2;Ca(HCO3)2+NaOH(过量) |
下列有关物质性质的比较顺序中,不正确的是( )
| A、热稳定性:HF>HCl>HBr>HI |
| B、微粒半径:K+>Na+>Mg2+>Al3+ |
| C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D、沸点:HF>HCl>HBr>HI |