题目内容
(1)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
①所需浓H2SO4的体积为 .
②如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好.
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌,目的是 .
④将 的上述溶液沿 注入 中,并用50mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要一并注入上述容量瓶中,并摇匀.
⑤加水至液面接近刻度线 时,改用 加水,使溶液的凹液面正好跟刻度线相平.
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①定容时观察液面俯视: ;
②烧杯,玻璃棒未洗涤: .
①所需浓H2SO4的体积为
②如果实验室有15mL、20mL、50mL量筒,应选用
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌,目的是
④将
⑤加水至液面接近刻度线
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①定容时观察液面俯视:
②烧杯,玻璃棒未洗涤:
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)①浓H2SO4的物质的量浓度c=
;根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;
②根据所需浓硫酸的体积选择量筒的规格,为减少误差选择略大于所需浓硫酸体积且规格相近的量筒;
③根据浓硫酸稀释的方法分析;
④根据溶液配制的步骤分析;
⑤胶头滴管可以进行定容;
(2)分析操作对溶质物质的量n、溶液体积V的影响,根据c=
判断操作对所配溶液浓度的影响.
| 1000ρw% |
| M |
②根据所需浓硫酸的体积选择量筒的规格,为减少误差选择略大于所需浓硫酸体积且规格相近的量筒;
③根据浓硫酸稀释的方法分析;
④根据溶液配制的步骤分析;
⑤胶头滴管可以进行定容;
(2)分析操作对溶质物质的量n、溶液体积V的影响,根据c=
| n |
| V |
解答:
解:(1)①浓H2SO4的物质的量浓度c=
=
mol/L=18.4mol/L;根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6,所以量取的浓硫酸体积是13.6mL,故答案为:13.6mL;
②所需浓硫酸的体积为13.6mL,所以选择15mL量筒,故答案为:15;
③浓硫酸稀释的方法为:稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入盛有水的烧杯中,同时用玻璃棒不断搅拌,以使热量及时地扩散,防止浓硫酸飞溅,切不可把水注入浓硫酸中,故答案为:防止浓硫酸飞溅;
④根据溶液的配置步骤可知,将冷却后的溶液沿着玻璃棒注入500mL容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要转移到容量瓶中,摇匀,
故答案为:冷却后;玻璃棒;500mL容量瓶;
⑤加水至液面接近刻度线 1-2cm时,改用胶头滴管加水,使溶液的凹液面正好跟刻度线相平,故答案为:1-2cm;胶头滴管;
(2)①定容时观察液面俯视,导致溶液的体积偏小,溶液的浓度偏高;
故答案为:偏高;
②烧杯,玻璃棒未洗涤,导致溶质的质量偏小,溶质的物质的量偏小,溶液的浓度偏低;
故答案为:偏低.
| 1000ρw% |
| M |
| 1000×1.84×98% |
| 8 |
②所需浓硫酸的体积为13.6mL,所以选择15mL量筒,故答案为:15;
③浓硫酸稀释的方法为:稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入盛有水的烧杯中,同时用玻璃棒不断搅拌,以使热量及时地扩散,防止浓硫酸飞溅,切不可把水注入浓硫酸中,故答案为:防止浓硫酸飞溅;
④根据溶液的配置步骤可知,将冷却后的溶液沿着玻璃棒注入500mL容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要转移到容量瓶中,摇匀,
故答案为:冷却后;玻璃棒;500mL容量瓶;
⑤加水至液面接近刻度线 1-2cm时,改用胶头滴管加水,使溶液的凹液面正好跟刻度线相平,故答案为:1-2cm;胶头滴管;
(2)①定容时观察液面俯视,导致溶液的体积偏小,溶液的浓度偏高;
故答案为:偏高;
②烧杯,玻璃棒未洗涤,导致溶质的质量偏小,溶质的物质的量偏小,溶液的浓度偏低;
故答案为:偏低.
点评:本题考查一定物质的量浓度溶液配制、物质的量浓度有关计算、仪器的选择等,难度不大.

练习册系列答案
相关题目
下列物质属于电解质的是( )
| A、石墨 | B、蔗糖 |
| C、稀硫酸 | D、NaCl |
用下列装置不能达到有关实验目的是( )
A、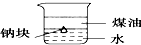 证明ρ(煤油)<ρ(钠)<ρ(水) |
B、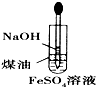 制备Fe(OH)2 |
C、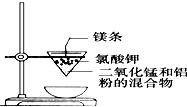 制取金属锰 |
D、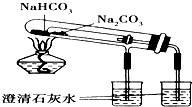 比较NaHCO3和Na2CO3的热稳定性 |
下列关于卤素元素的说法中不正确的是( )
| A、它们单质的熔、沸点随核电荷数的增加逐渐升高 |
| B、它们单质的颜色随核电荷数的增加逐渐加深 |
| C、它们单质的密度随核电荷数的增加逐渐增大 |
| D、它们氢化物的稳定性核电荷数的增加逐渐增强 |
用简便的方法鉴别硫酸铜、碳酸钠、氢氧化镁三种白色固体粉末,应选用的最佳试剂是( )
| A、稀盐酸 | B、紫色石蕊试液 |
| C、水 | D、氢氧化钠溶液 |
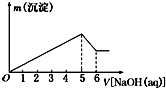 向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )
向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
下列各组中两种溶液间的反应,能用同一离子方程式来表示的是( )
| A、HCl+Na2CO3;H2SO4+KHCO3 |
| B、BaCl2+Na2SO4;Ba(OH)2+(NH4)2SO4 |
| C、Fe+H2SO4(稀);Fe+CH3COOH(稀) |
| D、NaHCO3(过量)+Ca(OH)2;Ca(HCO3)2+NaOH(过量) |