题目内容
实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是( )
| A、NaOH溶液 | B、硝酸银溶液 |
| C、盐酸 | D、氨水 |
考点:镁、铝的重要化合物
专题:
分析:根据题意,Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸反应又能和强碱反应,要使Al2(SO4)3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱.
解答:
解:Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸反应又能和强碱反应,要使Al2(SO4)3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱.
A、NaOH溶液是强碱,能溶解氢氧化铝沉淀,故A错误;
B、硝酸银溶液与AlCl3溶液反应生成氯化银沉淀,铝离子不参与反应,故B错误;
C、盐酸是酸,与Al3+不反应,故C错误;
D、氨水是弱碱,加入过量的氨水能把铝离子完全沉淀,故D正确;
故选D.
A、NaOH溶液是强碱,能溶解氢氧化铝沉淀,故A错误;
B、硝酸银溶液与AlCl3溶液反应生成氯化银沉淀,铝离子不参与反应,故B错误;
C、盐酸是酸,与Al3+不反应,故C错误;
D、氨水是弱碱,加入过量的氨水能把铝离子完全沉淀,故D正确;
故选D.
点评:本题考查铝的重要化合物的性质,难度不大,注意题目要求意在考查氢氧化铝的两性这一特性.

练习册系列答案
相关题目
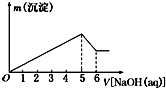 向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )
向某硫酸铝和硫酸镁的混合溶液中逐滴加入2mol?L-1的NaOH溶液,生成沉淀的质量m与加入NaOH溶液体积的关系如图所示,则原混合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为( )| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)=2Z(g)+W(s)△H<0,下列叙述正确的是( )
| A、达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| B、达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
| C、达到平衡时,反应速率v正(X)=2v逆(Z) |
| D、平衡常数K值越大,X的转化率越大 |
下列各变化中属于原电池反应的是( )
| A、在空气中金属铝表面迅速氧化形成保护层 |
| B、镀锌铁面有划损时,仍然能阻止铁被氧化 |
| C、红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D、锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
下列各组中两种溶液间的反应,能用同一离子方程式来表示的是( )
| A、HCl+Na2CO3;H2SO4+KHCO3 |
| B、BaCl2+Na2SO4;Ba(OH)2+(NH4)2SO4 |
| C、Fe+H2SO4(稀);Fe+CH3COOH(稀) |
| D、NaHCO3(过量)+Ca(OH)2;Ca(HCO3)2+NaOH(过量) |
下列反应氯元素只被氧化的是( )
| A、5Cl2+I2+6H2O=10HCl+2HIO3 | ||||
B、2NaCl
| ||||
| C、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | ||||
D、2HClO
|