题目内容
19.将47.5gMgCl2固体全部溶于水配成500ml溶液,此溶液中氯离子的物质的量浓度为2mol/L.分析 n(MgCl2)=$\frac{47.5g}{95g/mol}$=0.5mol,氯化镁是可溶性盐,在水溶液中完全电离,根据Cl原子守恒得c(Cl-)=2c(MgCl2)=2×$\frac{n(MgC{l}_{2})}{V}$,据此分析解答.
解答 解:n(MgCl2)=$\frac{47.5g}{95g/mol}$=0.5mol,氯化镁是可溶性盐,在水溶液中完全电离,根据Cl原子守恒得c(Cl-)=2c(MgCl2)=2×$\frac{n(MgC{l}_{2})}{V}$=2×$\frac{0.5mol}{0.5L}$=2mol/L,
故答案为:2mol/L.
点评 本题考查物质的量浓度有关计算,为高频考点,明确氯离子浓度与氯化镁浓度关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
14.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
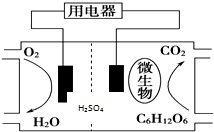

| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
5.关于用水制取二级能源氢气,以下研究方向不正确的是( )
| A. | 设法将太阳光聚焦,产生高温,使水分解产生氢气 | |
| B. | 寻找特殊化学物质,使水分解产生氢气,同时释放能量 | |
| C. | 寻找特殊化学物质,用于开发廉价能源以分解水制取氢气 | |
| D. | 构成水的氢气和氧气都是可燃烧的物质,因此可研究在水不分解的情况下,使氢能成为二级能源 |
12.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
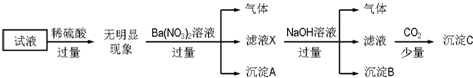
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
9.在石灰窑中烧制生石灰,1molCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供.设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是( )
| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
10. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl |