题目内容
9.在石灰窑中烧制生石灰,1molCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供.设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是( )| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
分析 先计算完全燃烧0.453mol碳需要的空气的量,再计算所需空气中含有的氮气的量,同时有0.453molCO2生成,还有1molCaCO3完全分解产生的气体,进行解答本题.
解答 解:完全燃烧0.453mol碳需要消耗0.453mol氧气(按空气中O2体积分数为0.21)计算,
则至少要空气的量为$\frac{0.453}{0.21}$=2.157摩尔,
其中含氮气的量为:2.157×0.79=1.704摩尔;
C+O2$\frac{\underline{\;点燃\;}}{\;}$ CO2,CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2 ↑,
1 1 1 1
0.453 x 1 y
由反应方程式可知:完全燃烧0.453mol碳生成 x=0.453mol 二氧化碳;
1mol碳酸钙分解生成y=1mol二氧化碳;
石灰窑产生的气体中CO2的体积分数=$\frac{1+0.453}{1+0.453+1.704}$×100%=45.9%≈46%;
这是最大值,如部分生成CO,则二氧化碳体积分数变小;
故选A.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
18.下列性质不属于金属共性的是( )
| A. | 电热的良导体 | B. | 金属阳离子的氧化性 | ||
| C. | 单质的还原性 | D. | 高沸点 |
17.如表是元素周期表的一部分
(1)表中元素F的非金属性最强(填写元素符号,下同);元素Br的单质室温下呈液态,它的原子序数是35.
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有的相同的化学键是非极性共价键键(填写“离子键”、“极性共价键”或“非极性共价键”),元素⑤和⑦组成原子比例为1:1的物质的电子式为 .
.
(3)表中元素⑥⑩⑬氢化物的稳定性由大到小的顺序为:HF>HCl>HBr(填写化学式,下同);
(4)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是第三周期ⅣA族.
| 族 周期 | |||||||
| ① | |||||||
| Li | C | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||
| K | ⑫ | ⑬ | |||||
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有的相同的化学键是非极性共价键键(填写“离子键”、“极性共价键”或“非极性共价键”),元素⑤和⑦组成原子比例为1:1的物质的电子式为
 .
.(3)表中元素⑥⑩⑬氢化物的稳定性由大到小的顺序为:HF>HCl>HBr(填写化学式,下同);
(4)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是第三周期ⅣA族.
18.下列说法中正确的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可以有效延长其保持期 | |
| B. | 利用丁达尔效应可区分淀粉溶液和NaCl溶液 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌 | |
| D. | 石油分馏属于化学变化 |
19.常温下,在下列溶液里,各组离子一定能够大量共存的是( )
| A. | 无色溶液:Na+、K+、SO42-、MnO4- | |
| B. | pH=1的溶液中:Fe2+、SO42-、Cl-、NO3- | |
| C. | 使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+、 | |
| D. | 水电离出的c(H+)=1×10-12mol/L的溶液:K+、Cl-、Ba2+、Br- |
 .
.
 随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.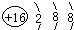 .
.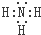 .
.