题目内容
18.参考如图和有关要求回答问题: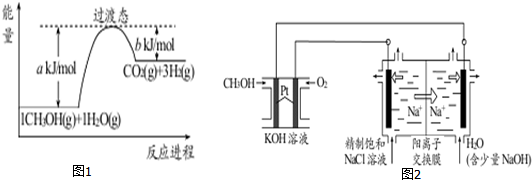
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2.图1是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是减小 (填“增大”、“减小”、“不变”),反应热△H的变化是不变(填“增大”、“减小”、“不变”).
(2)以CH3OH燃料电池为电源电解法制取ClO2.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH增大(填“增大”、“减小”、“不变”).负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②图2中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2.阳极产生 ClO2的反应式为Cl--5e-+2H2O=4H++ClO2↑.
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为1mol.
(3)图2中电解池改为用石墨作电极,在一定条件下电解0.05mol•L-1的硫酸铜溶液200ml,当两极产生的气体体积相同时,
①发生电解的总反应方程式为2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑
②若电解后溶液的体积还是200ml,溶液的pH=1
③电解后加入下列B固体物质可使溶液恢复到电解前
A CuO B Cu (OH)2C CuCO3D CuSO4.
分析 (1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变.根据图象可知反应热=akJ/mol-bkJ/mol,所以CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol.
(2)以CH3OH燃料电池为电源电解法制取ClO2,二氧化氯(ClO2)为一种黄绿色气体,通入O2的电极是正极,负极甲醇失去电子在碱溶液中生成碳酸盐,
①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子在碱溶液中生成碳酸盐;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2,结合电子守恒和电荷守恒配平书写;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量是0.3mol.设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol;
(3)电解CuSO4溶液质量增重的一极是电解池的阴极,析出铜,同时会产生氢气,电解方程式为:2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,也可根据电解池两极上转移的电子数目相等计算,利用反应式来计算pH,根据电解方程式计算.
解答 解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a-b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
故答案为:减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol;
(2)①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,
故答案为:增大;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2的反应式为:Cl--5e-+2H2O=4H++ClO2↑,
故答案为:Cl--5e-+2H2O=4H++ClO2↑;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol,
故答案为:1;
(3)①电解总反应式为2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,故答案为:2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑;
②电解硫酸铜溶液0.01mol,阴极上发生反应:Cu2++2e-═Cu,2H++2e-═H2↑,0.01mol铜离子得电子转移0.02mol电子,若产生224mL即0.01mol气体,转移电子是0.022mol,共0.04mol电子转移,阳极上发生反应4OH--4e-═2H2O+O2↑,产生相同气体,若为224mL即0.01mol气体,转移电子的物质的量是0.04mol,根据反应式:2CuSO4+2H20$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,当生成0.01mol铜,生成硫酸是0.01mol,所以氢离子浓度是$\frac{0.01mol×2}{0.2L}$=0.1mol/L,所以pH=1;故答案为:1;
③电解过程中少什么加什么,少多少加多少,根反应式:阴极上发生反应:Cu2++2e-═Cu,2H++2e-═H2↑,阳极上发生反应4OH--4e-═2H2O+O2↑,析出了铜,跑掉了氧气和氢气,故选B.
点评 本题主要是考查反应热的计算、盖斯定律应用及电化学原理的应用,注意原电池和电解池的原理分析和电极反应书写,题目难度中等.

已知:
①MnO4-在酸性环境下的还原产物是Mn2+
实验用品:仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4•2H2O)1.3 g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如表所示:
| 试管1 | 试管2 | |
| 实验现象 | 褪色很快 | 褪色很慢 |
| 褪色时间/s | 4秒 | 31秒 |
①甲同学进行该实验还缺少的实验仪器是:秒表.
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③同学测出的颜色变化的时间是以下列哪个选项为依据的C.
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是Mn2+离子在反应中起到催化剂的作用,加快了反应速率.于是甲同学得出结论在其它条件不变的情况下,加入催化剂可加快化学反应速率.
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I该反应是放热反应,温度升高,反应速率增大,溶液褪色加快 II加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应.
| A. | HCl | B. | NH3•H2O | C. | H2SO3 | D. | HClO |
| A. | H2+CuO═Cu+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | H2+Cl2═2HCl | D. | 2NaOH+Cl2═NaCl+NaClO+H2O |
| A. | NaH2PO4溶液PH<7,则在溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.1mol•L-1NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CH3COOH溶液等体积混合(pH<7)c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| D. | 0.2mol•L-1NaHCO3溶液与0.1mol•L-1Na2CO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
 已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:
已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:(1)N2H4、H2O2的组成元素中第一电离能最大的元素是N.
(2)钛的原子序数是22,其基态原子的核外电子排布式为[Ar]3d24s2.
(3)1molN2H4分子中所含极性键的数目为4NA.
(4)H2O2受热易分解为H2O,H2O的空间构型为V形.其中心原子的杂化轨道类型为sp3.
(5)H2S和H2O2的主要物理性质如表所示:
| 物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
(6)氧化镁和氮化硼均可用作返回舱的热屏蔽材料,晶格能:氧化镁大于氧化钙(填“大于”或“小于”).
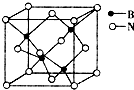
(7)立方氮化硼的晶胞如图所示,则处于晶胞顶点的原子的配位数为4,若晶胞边长为a pm,则立方氮化硼晶胞的密度是$\frac{100}{{{N_A}{{(a×{{10}^{-10}})}^3}}}$g•cm-3(只要求列算式,阿伏伽德罗常数为NA).
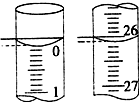 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白: .
. ,写出另一种盐的电子式
,写出另一种盐的电子式 .
.