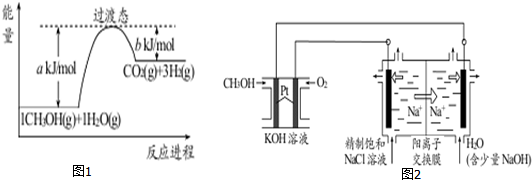
题目内容
6. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由浅红色色变为无色色,并半分钟内不褪色为止.
(2)下列操作中对所测NaOH溶液的浓度数值有何影响?填“偏高”、“偏低”或“无影响”.
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸偏高
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥无影响
C.酸式滴定管在滴定前有气泡,滴定后气泡消失偏高
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数偏低
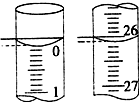
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL,所用盐酸溶液的体积为26.10mL.
分析 (1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定结束前溶液为浅红色,滴定结束时溶液变为无色,据此判断滴定终点;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3)根据滴定管的结构和精确度以及测量的原理.
解答 解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由浅红色突变为无色,且半分钟内不褪色;
故答案为:锥形瓶中溶液颜色的变化;浅红色;无色;半分钟内不褪色;
(2)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大;
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)无影响;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏小;
故答案为:偏高;无影响;偏高;偏低;
(3)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL,故答案为:0.00;26.10;26.10.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
17.下列有关物质的用途叙述中,不正确的是( )
| A. | 用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性 | |
| B. | 干冰用于人工降雨,是利用了干冰升华吸热 | |
| C. | 胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素 | |
| D. | 碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应 |
18.《唐诗三百首》中白居易的《问刘十九》:”绿蚁新醅酒,红泥小火炉.晚来天欲雪,能饮一杯无?“其中含有化学过程的是哪一句?( )
| A. | 第一句 | B. | 第二句 | C. | 第三句 | D. | 第四句 |
14.(1)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为10mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验①⑤或②④(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究不同反应物浓度对化学反应速率的影响.
(2)已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色.针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入B(填字母序号)做对比实验.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
(2)已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色.针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入B(填字母序号)做对比实验.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
1. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的现象是最后一滴NaOH溶液滴入后,锥形瓶中溶液恰好出现红色,且半分钟内红色不褪去.
②根据上述数据,计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③下列操作(其他操作正确)会造成实验测定结果偏高的有DF.(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
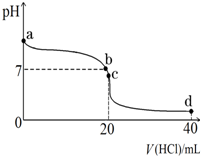
(3)室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
①NH3•H2O的电离方程式是NH3•H2O?NH4++OH-.
②b点所示溶液中的溶质是NH4Cl、NH3?H2O.
③c点所示溶液中,离子浓度从大到小的关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-),在该溶液中存在多种守恒关系,其中c(NH4+)+c(H+)=c(Cl-)+c(OH-)(用离子浓度表示).
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
②根据上述数据,计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③下列操作(其他操作正确)会造成实验测定结果偏高的有DF.(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
(3)室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
①NH3•H2O的电离方程式是NH3•H2O?NH4++OH-.
②b点所示溶液中的溶质是NH4Cl、NH3?H2O.
③c点所示溶液中,离子浓度从大到小的关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-),在该溶液中存在多种守恒关系,其中c(NH4+)+c(H+)=c(Cl-)+c(OH-)(用离子浓度表示).
15.下列除去少量杂质(括号内为杂质),所选试剂和方法都正确的是( )
| A. | 乙烷(乙烯):催化剂和H2,加热 | B. | 苯(苯酚):氢氧化钠溶液,分液 | ||
| C. | CO2(SO2):饱和碳酸钠溶液,洗气 | D. | 溴苯(溴):苯和铁粉,过滤 |
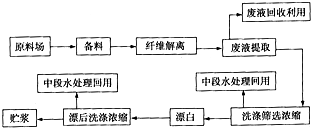
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.