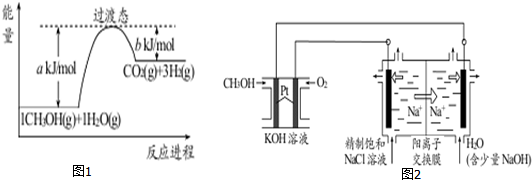
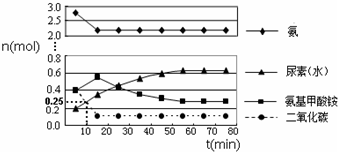
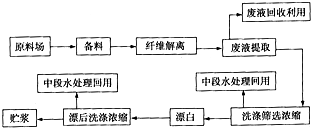
题目内容
7.下列溶液中粒子的物质的量浓度关系正确的是( )| A. | NaH2PO4溶液PH<7,则在溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液与0.1mol•L-1NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CH3COOH溶液等体积混合(pH<7)c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| D. | 0.2mol•L-1NaHCO3溶液与0.1mol•L-1Na2CO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
分析 A.NaH2PO4溶液的pH<7,说明H2PO4-的电离程度大于其水解程度,则c(HPO42-)>c(H3PO4);
B.根据混合液中的电荷守恒判断;
C.混合液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Na+)>c(CH3COOH);
D.根据混合液中的物料守恒判断.
解答 解:A.NaH2PO4溶液的pH<7,溶液显示酸性,说明H2PO4-的电离程度大于其水解程度,则c(HPO42-)>c(H3PO4),正确的浓度大小为:c(Na+)>c(H2PO4-)>c(HPO42-)>c(H3PO4),故A错误;
B.0.1mol•L-1(NH4)2SO4溶液与0.1mol•L-1NH3•H2O溶液等体积混合,根据电荷守恒可知:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),故B正确;
C.0.1mol•L-1CH3COONa溶液与0.1mol•L-1CH3COOH溶液等体积混合(pH<7),说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)可知:c(CH3COO-)>c(Na+)>c(CH3COOH),正确的浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;
D.0.2mol•L-1NaHCO3溶液与0.1mol•L-1Na2CO3溶液等体积混合,根据物料守恒可得:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,注意掌握盐的水解原理及其应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 第一句 | B. | 第二句 | C. | 第三句 | D. | 第四句 |
| A. | 乙烷(乙烯):催化剂和H2,加热 | B. | 苯(苯酚):氢氧化钠溶液,分液 | ||
| C. | CO2(SO2):饱和碳酸钠溶液,洗气 | D. | 溴苯(溴):苯和铁粉,过滤 |
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,4.6gCH3CH2OH中含有 6NA个C-H键 | |
| C. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
| A. | 绿色化学的核心理念是对环境污染进行综合治理 | |
| B. | 现代研制的油漆中一般不使用甲醛等化合物,因为这些化合物对人体有害 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
| A. | 用A表示的反应速率是0.4mol/(L•min) | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 若在恒容时充入与反应无关的气体Ar,由于增大了容器内的压强,而加快了反应速率 | |
| D. | 当B的消耗速率与C的消耗速率相等时,反应达到了平衡 |