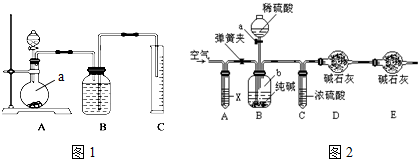
题目内容
1.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3).碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+KI+H2SO4→I2+K2SO4+H2O①该反应中,氧化剂是KIO3,氧化产物是I2.
②配平此化学反应方程式5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O
③当有3mol I2生成时,有5mol还原剂被氧化.
分析 KIO3+KI+H2SO4→I2+K2SO4+H2O中,KI中I元素的化合价由-1价升高为0,KIO3中I元素的化合价由+5价降低为0,结合氧化还原反应中基本概念来解答.
解答 解:(1)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,则氧化剂是KIO3,还原剂是KI,氧化产物为I2,故答案为:KIO3; I2;
(2)KIO3+KI+H2SO4→I2+K2SO4+H2O中,KI中I元素的化合价由-1价升高为0,KIO3中I元素的化合价由+5价降低为0,反应的化学方程式为5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O,故答案为:5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O;
(3)由方程式可知,该反应中生成3molI2,有5molKI被氧化,故答案为:5.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
12.根据下列方程式判断下列微粒的氧化性顺序按由强到弱顺序排列的是( )
2Fe2++Cl2═2Fe3++2Cl-;
2Fe3++2I-═2Fe2++I2;
I2+SO2+2H2O═4H++2I-+SO42-.
2Fe2++Cl2═2Fe3++2Cl-;
2Fe3++2I-═2Fe2++I2;
I2+SO2+2H2O═4H++2I-+SO42-.
| A. | Fe3+>I2>SO2>Cl2 | B. | Cl2>Fe3+>I2>SO2 | C. | I2>Cl2>Fe3+>SO2 | D. | Cl2>SO2>I2>Fe3+ |
9.下列离子方程式书写正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Mg(OH)2与盐酸的反应:OH-+H+═H2O | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
16.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | $\frac{K_W}{{c({H^+})}}$=10-13mol•L-1溶液中:NH4+、Mg2+、NO3-、SO32- | |
| C. | 通入大量CO2的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
6.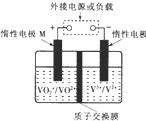 全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
 全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 充电过程中,N电极附近酸性减弱 | |
| B. | 充电过程中,N电极上V3+被还原为V2+ | |
| C. | 放电过程中,H+由N电极向M电极移动 | |
| D. | 放电过程中,M电极反应为V02++2H++e-═V02++H20 |
11.下列叙述中正确的是( )
| A. | 二氧化碳能灭火,所以燃着的镁条在二氧化碳中便熄灭 | |
| B. | 硬铝的硬度比铝大,熔点比铝低 | |
| C. | 相同质量的铜分别跟足量的浓硝酸或稀硝酸反应,产生气体的体积比为1:1 | |
| D. | 相同质量的铝分别跟足量的稀盐酸酸或氢氧化钠溶液共热,产生气体体积相同 |
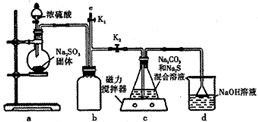 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.