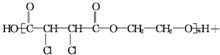题目内容
6.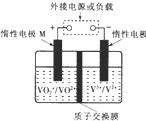 全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 充电过程中,N电极附近酸性减弱 | |
| B. | 充电过程中,N电极上V3+被还原为V2+ | |
| C. | 放电过程中,H+由N电极向M电极移动 | |
| D. | 放电过程中,M电极反应为V02++2H++e-═V02++H20 |
分析 充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,放电时正极上反应式:VO2++2H++e-═VO2++H2O,充电时,阴极上发生得电子的还原反应,即V3++e-═V2+,放电池负极发生V2+-e-═V3+,以此解答该题.
解答 解:A.充电时,阴极上发生得电子的还原反应,即V3++e-═V2+,氢离子不参与电极反应,故A错误;
B.充电过程中,N电极上发生还原反应,V3+被还原为V2+,故B正确;
C.放电过程中,阳离子向正极移动,即由N电极向M电极移动,故C正确;
D.放电时正极上反应式:VO2++2H++e-═VO2++H2O,故错误.
故选AD.
点评 本题考查了化学电源新型电池,为高频考点,根据充放电时各个电极上得失电子来分析解答,难点是电极反应式的书写,要根据电解质溶液酸碱性书写,难度中等.

练习册系列答案
相关题目
17.含有0.20mol碳酸钠的溶液250mL和100mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 2.0mol/L | B. | 0.24mol/L | C. | 0.19 mol/L | D. | 3 mol/L |
14.已知:2CO(g)+O2(g)═2CO2(g);△H=-566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$;△H=-226kJ/mol
根据以上热化学方程式判断,下列说法不正确的是( )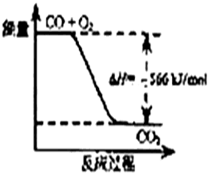
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$;△H=-226kJ/mol
根据以上热化学方程式判断,下列说法不正确的是( )

| A. | CO的燃烧热为283 kJ/mol | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
18.下列实验操作中,正确的是( )
| A. |  称量 | B. |  转移 | ||
| C. |  过滤 | D. |  蒸馏 |
16.已知:2CO(g)+O2(g)═2CO2(g)△H=-565.2kJ•molˉ1,下列说法不正确的是( )
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
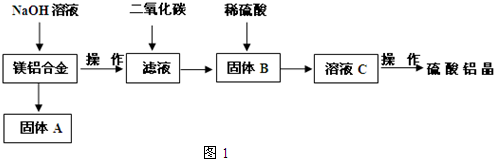
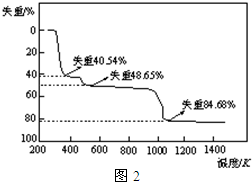 (5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.

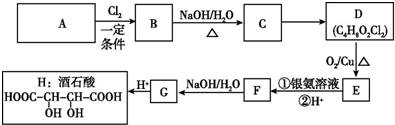
 +Cl3$\stackrel{一定条件}{→}$
+Cl3$\stackrel{一定条件}{→}$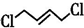
 ;
;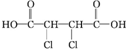 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$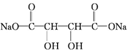 +2NaCl+2H2O;
+2NaCl+2H2O;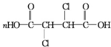 +n
+n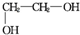 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$